| ||||||||
Badanie multiparametryczne MRI (mpMRI) w PI-RADS v2Komentarz dotyczący sposobu przeprowadzania badania multiparametrycznego MRI w PI-RADS v2 Część 3Obrazy T1-zależne (T1W) oraz T2-zależne (T2W)Każde badanie MR stercza powinno zawierać zarówno obrazy T1-, jak i T2-zależne. Obrazy T1-zależne są stosowane głównie w celu wykrycia ognisk krwawienia w sterczu oraz pęcherzykach nasiennych oraz określenia konturu/zarysu gruczołu. Obrazy T1-zależne mogą być również przydatne dla wykrycia przerzutów do węzłów i układu kostnego, zwłaszcza po dożylnym podaniu gadolinowych środków kontrastowych (GBCA). Obrazy T2-zależne służą do identyfikacji stref anatomicznych gruczołu krokowego, oceny nieprawidłowości w gruczole oraz oceny naciekania pęcherzyków nasiennych poza gruczoł krokowy (EPE) i zajęcia węzłów chłonnych. Na obrazach T2-zależnych istotna klinicznie postać raka w strefie obwodowej zwykle widoczna jest jako okrągła lub słabo odgraniczona hipointensywna zmiana ogniskowa. Jednak obraz ten nie jest specyficzny i może występować także w przypadku innych zmian, takich jak zapalenie stercza, krwawienie, zmiany zanikowe, łagodny przerost, blizny po biopsji oraz po terapii (hormonalnej, ablacyjnej, itp.). Na obrazach T2-zależnych guzy strefy przejściowej występują jako jednorodne, nieostro odgraniczone, umiarkowanie hipointensywne zmiany ("rozmazany węgiel drzewny" lub wygląd "rozmazanego odcisku palca") o spikularnych brzegach, soczewkowatego kształtu, z brakiem kompletnej hipointensywnej torebki, z naciekaniem cewki moczowej oraz przedniego zrębu włóknisto-mięśniowego. Im więcej cech jest obecnych, tym większe prawdopodobieństwo klinicznie istotnej postaci raka w strefie przejściowej. Nowotwory strefy przejściowej mogą być trudne do rozpoznania na obrazach T2-zależnych, ponieważ strefa przejściowa często składa się z różnych przenikających się wzajemnie elementów tkanki gruczołowej (o wysokiej intensywności sygnału na obrazach T2-zależnych) i zrębu (o niskiej intensywności sygnału na obrazach T2-zależnych), w ten sposób przedstawiając heterogeniczną intensywność sygnału. Obszary, w których przeważają łagodne elementy zrębu, mogą imitować lub zasłaniać klinicznie istotną postać raka. Zarówno raki strefy obwodowej, jak i przejściowej mogą przekraczać granice anatomiczne. O charakterze inwazyjnym świadczy szerzenie się procesu na sąsiednie strefy w obrębie gruczołu, na pęcherzyki nasienne lub poza gruczoł krokowy (EPE). Specyfikacja techniczna
Obrazy T2-zależne
Osiowe obrazy 3D mogą być uzupełnieniem do obrazów 2D. Obrazy 3D uzyskane za pomocą voxela izotropowego mogą być szczególnie przydatne w celu uwidocznienia szczegółów anatomicznych oraz odróżnienia rzeczywistych zmian od efektu częściowego uśrednienia objętościowego. Jednakże zróżnicowanie kontrastowe tkanek miękkich może się różnić i w niektórych przypadkach być gorsze niż w przy zastosowaniu obrazów 2D T2-zależnych, a rozdzielczość może być gorsza niż na odpowiadających przekrojach na obrazach 2D.
Obrazy T1-zależne Ocena PIRADS w przypadku obrazów T-zależnych 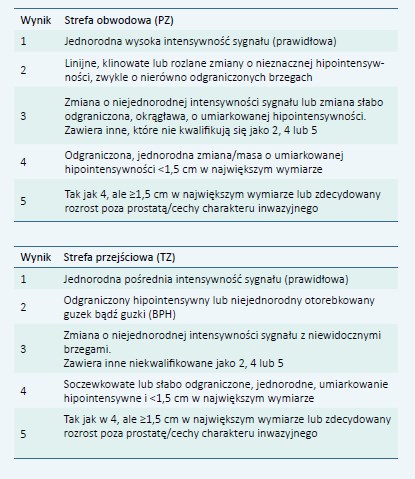
Obrazowanie dyfuzyjne (DWI)Obrazowanie dyfuzyjne (DWI) odzwierciedla przypadkowy ruch cząsteczek wody i jest kluczowym komponentem badania mpMRI prostaty. Powinno zawierać mapę ADC oraz obrazy o wysokiej wartości współczynnika b. Mapa ADC Mapa ADC jest odzwierciedleniem wartości ADC dla każdego voxela na obrazie. W większości obecnych zastosowań klinicznych, w celu obliczenia wartości ADC stosuje się dwie lub więcej wartości b oraz monowykładniczy model zaniku sygnału ze wzrostem wartości b. Większość istotnych klinicznie postaci raka wykazuje ograniczoną/utrudnioną dyfuzję w porównaniu do prawidłowych tkanek i dlatego widoczne są jako hipointensywne na mapach ADC (w skali szarości). Chociaż ustalono, że wartości ADC korelują odwrotnie proporcjonalnie ze stopniem złośliwości, istnieje istoistotne pokrywanie się w tym względzie pomiędzy BPH, nowotworami niskiego i wysokiego stopnia. Ponadto na obliczenie ADC ma wpływ wybór wartości parametru b, co niestety nie zostało objęte normalizacją przez producentów sprzętu. Dlatego stosuje się jakościową ocenę wizualną jako podstawową metodę oceny ADC. Niemniej jednak wartości ADC, stosując próg 750- 900 µm2/s, mogą okazać się przydatne w różnicowaniu pomiędzy łagodnymi i złośliwymi zmianami w obrębie prostaty w strefie obwodowej, a wartości ADC poniżej progu wskazują na istotną klinicznie postać raka. Obrazy o "wysokiej wartości współczynnika b" Obrazy o "wysokiej wartości współczynnika b" zakładają zastosowanie wartości współczynnika dyfuzyjności b w zakresie ≥1400 s/mm2. Odzwierciedlają one zachowanie sygnału w obszarach o ograniczonej dyfuzji w porównaniu do tkanek prawidłowych, które prezentują obniżony sygnał na skutek większej dyfuzji między zastosowanymi gradientami o różnych wartościach współczynnika b. W porównaniu do map ADC, odzwierciedlenie istotnych klinicznie postaci raka jest lepsze na obrazach z wysokimi wartościami współczynnika b, zwłaszcza przylegających lub naciekających przedni zrąb włóknisto-mięśniowy w lokalizacji podtorebkowej oraz na wierzchołku i przy podstawie gruczołu. Obrazy DWI o wysokiej wartości współczynnika b można uzyskać na dwa sposoby: bezpośrednio otrzymując sekwencję DWI wysokiej wartości współczynnika b (wymaga dodatkowego czasu skanowania) lub poprzez obliczenie na drodze ekstrapolacji z zebranych danych z niską wartością b, stosowanych do tworzenia mapy ADC (potencjalnie mniej wrażliwe na artefakty, ponieważ nie wymagają dłuższego TE - czasu echa, potrzebnego do akomodacji silnego pulsu do pozyskania wartości b). Wraz ze wzrostem wartości współczynnika b, współczynnik sygnału do szumu (SNR) spada, dlatego optymalny poziom wysokiej wartości współczynnika b może zależeć od siły pola magnetycznego, oprogramowania i producenta. Obecnie nie ma powszechnie akceptowanych optymalnych wysokich wartości współczynnika b, ale jeśli pozwala na to stosunek sygnału do szumu, stosowanie wartości b 1400-2000 s/mm2 wydaje się przynosić korzyści. Specyfikacja techniczna Zalecana jest sekwencja EPI echa spinowego na wolnym oddechu w połączeniu z saturacją tłuszczu.
W przypadku map ADC, jeśli można pozyskać tylko dwie wartości współczynnika b na skutek ograniczeń czasowych lub technicznych, zaleca się ustawienie najniższej wartości b na 50-100 s/mm2, najwyższa wartość powinna wynosić 800-1000 s/mm2. Dodatkowe wartości b pomiędzy 100 i 1000 s/mm2 mogą zapewnić dokładniejsze obliczenie ADC poprzez ekstrapolację obrazów o wysokich wartościach współczynnika b (>1400 s/mm2). Informacje dotyczące charakteru perfuzji tkankowej można uzyskać dzięki dodatkowym wartościom współczynnika b - w zakresie od 0 s/mm2 do 500 s/mm2. PI-RADS ocena DWI Intensywność sygnału zmiany powinna być wizualnie porównywalna z przeciętnym sygnałem "prawidłowej" tkanki prostaty w strefie histologicznej, w której zmiana ta jest zlokalizowana. 
Zastrzeżenia dla DWI Zmiany w DWI powinny zawsze być korelowane z obrazami T2-zależnymi, T1-zależnymi oraz DCE. Z przyczyn technicznych jednostki intensywności sygnału dla różnych skanerów nie zostały ujednolicone i nie są analogiczne do jednostek gęstości Hounsfielda stosowanych w CT. Skutkiem powyższego jest brak standardowych "okien stercza", które mają zastosowanie do obrazów otrzymanych ze wszystkich skanerów MR. Istotne klinicznie postaci raków mają ograniczoną/ utrudnioną dyfuzję i powinny być widoczne jako hipointensywne na mapach ADC. Zdecydowanie zaleca się, aby mapy ADC dla określonych skanerów były ustawione tak, by istotne klinicznie postaci raków były na nich widoczne jako obszary wyraźnie hipointensywne. Ponadto powinny być wyświetlane w takich samych ustawieniach kontrastu (szerokość i poziom okna). Przydatne mogą być wytyczne radiologów, którzy mają doświadczenie we współpracy z określonymi producentami lub skanerami. Mapy ADC kodowane kolorem mogą być przydatne podczas standaryzacji obrazów i oceny obrazów z poszczególnych skanerów, ale nie pozwalają na rozwianie wątpliwości dotyczących powtarzalności wartości ADC. Zmiany łagodne i prawidłowe struktury anatomiczne (np. kamica i inne zwapnienia, obszary zwłóknień lub gęsty zrąb włóknisto-mięśniowy oraz elementy morfotyczne krwi, zwykle związane z wcześniejszą biopsją) mogą być bezsygnałowe lub niskosygnałowe na obrazach T2-zależnych oraz mapach ADC. Jednak w odróżnieniu od istotnych klinicznie postaci raka gruczołu krokowego te jednostki będą również wyraźnie hipointensywne na wszystkich obrazach DWI. Niektóre guzki łagodnego rozrostu stercza w strefie przejściowej nie są wyraźnie otorebkowane i mogą prezentować hipointensywność na mapach ADC i hiperintensywności przy wysokich wartościach b na mapach DWI. Chociaż w niektórych przypadkach cechy morfologiczne mogą być przydatne w ocenie, trzeba mieć świadomość ograniczonych możliwości diagnostycznych w ich interpretacji. Otorebkowany, odgraniczony, okrągły guzek w strefie obwodowej, nawet jeżeli jest hipointensywny w ADC, jest prawdopodobnie uwypuklonym guzkiem BPH. Ocena PI-RADS dla takiej zmiany powinna wynosić 2. Dynamiczne wzmocnienie kontrastowe (DCE) MRIDynamiczne wzmocnienie kontrastowe definiuje się jako uzyskanie szybkiego skanu T1-zależnego echa gradientowego przed, podczas i po dożylnym podaniu niskocząsteczkowego, gadolinowego środka kontrastowego (GBCA). Podobnie jak w innych przypadkach zmian złośliwych, po bolusie środka kontrastowego ognisko raka stercza wykazuje wczesne wzmocnienie w porównaniu do prawidłowej tkanki. Jednakże rzeczywista kinetyka wzmocnienia raka jest zmienna i niejednorodna. Niektóre nowotwory złośliwe wykazują wczesne wypłukiwanie, podczas gdy inne zachowują zakontrastowanie dłużej. Ponadto samo wzmocnienie nie jest rozstrzygające w przypadku istotnej klinicznie postaci raka, a i brak wczesnego wzmocnienia kontrastowego nie wyklucza takiej możliwości. Ocena dynamicznego wzmocnienia kontrastowego powinna się znaleźć we wszystkich multiparametrycznych badaniach MRI stercza, aby nie pominąć niewielkich istotnych klinicznie ognisk raka. Dane z DCE powinny być zawsze bliżej zbadane pod kątem wczesnego wzmocnienia ogniskowego. Jeżeli takowe zostały uwidocznione, wtedy odpowiadające obrazy T2-zależne i dyfuzyjne należy dokładnie przeanalizować w kierunku odpowiadającej nieprawidłowości. Obecnie nie ustalono żadnej wartości dodanej DCE i z większości opublikowanych danych wynika, że wartość dodana DCE ponad kombinacje T2W i DWI jest niewystarczająca. Dlatego też, chociaż DCE jest niezbędnym elementem badania prostaty mpMRI, jego rola w określeniu kategorii oceny PI-RADS v2 jest drugorzędna w stosunku do obrazów T2-zależnych i DWI. DCE jest oceniane jako dodatnie, kiedy wzmocnienie jest ogniskowe, wcześniejsze lub równoczesne względem wzmocnienia sąsiadujących tkanek prostaty i zwykle odpowiada podejrzanym zmianom widocznym na obrazach T2-zależnych i/lub DWI. Dodatnie wzmocnienie kontrastowe zwykle uwidacznia się w ciągu 10 sekund od pojawienia się wstrzykniętego środka kontrastowego w tętnicach udowych (w zależności od rozdzielczości czasowej stosowanej do osiągnięcia obrazów, prędkości podawania środka kontrastowego, rzutu serca i innych czynników). Najbardziej powszechną metodą analizowania DCE jest bezpośrednia ocena wizualna kolejnych akwizycji DCE w każdej warstwie, wykonana manualnie lub w trybie cine. Wizualna ocena wzmocnienia może być ułatwiona poprzez saturację tłuszczu lub techniki subtrakcyjne (zwłaszcza w obecności elementów morfotycznych, które są hiperintensywne w badaniu natywnym na obrazach T1-zależnych). Ocena wizualna może być również wspomagana przez mapę parametryczną kodowaną kolorem (np. nachylenie i szczyt). Jednakże wszelkie podejrzane zmiany w obrazach subtrakcyjnych lub mapach parametrycznych zawsze powinny być potwierdzone na obrazach źródłowych. Znaczny wysiłek pochłonął proces określania rodzajów krzywych curve typing (np. sporządzanie kinetyki wykresu zmian jako funkcji sygnału vs czasu). Zauważono jednak, że istnieje wielka różnorodność charakterystyki wzmocnienia kontrastowego w raku stercza i obecnie w literaturze jest niewiele dowodów na poparcie użycia określonych typów krzywej. Inne podejście zakłada stosowanie farmakokinetycznego modelowania przedziałowego, które uwzględnia stężenie środka kontrastowego, nie zaś wyjściową intensywność sygnału i funkcję napływu tętniczego w celu obliczenia stałych czasu do szybkości napływu (K-trans) i wypłukiwania (kep) środka kontrastowego. Dostępne są programy generujące "mapy" K-trans i kep, które mogą poprawić widoczność zmian. Chociaż analiza farmakodynamiczna (PD) może dostarczyć cennych spostrzeżeń dotyczących zachowania guza i analizy biomarkerów służących do opracowania leków, jednak komisja koordynacyjna PI-RADS uważa, że ilość zweryfikowanych i opublikowanych danych lub uznanych przez ekspertów nadal jest niewystarczająca, aby rutynowo przyjąć tę metodę analizy do użytku klinicznego. Dlatego też, zgodnie z PI-RADS v2, "dodatnie" wzmocnienie kontrastowe stwierdza się tam, gdzie wzmocnienie jest ogniskowe, wcześniejsze lub równoczesne w porównaniu do wzmocnienia sąsiadujących prawidłowych tkanek prostaty i odpowiada zmianom na obrazach T2-zależnych i/lub DWI. W strefie przejściowej guzki BPH często wzmacniają się wcześnie, ale zwykle prezentują charakterystyczną łagodną morfologię (okrągły kształt, wyraźne odgraniczenie). "Ujemne" wzmocnienie kontrastowe stwierdza się wtedy, gdy zmiana nie wzmacnia się wcześniej w stosunku do otaczającej tkanki prostaty lub wzmacnia się w sposób rozlany, a brzegi wzmacniającego się obszaru nie odpowiadają zmianie w obrazach T2-zależnych i/lub DWI. Opis techniczny Dynamiczne badanie kontrastowe jest zwykle prowadzone przez kilka minut w celu oceny charakteru wzmocnienia. W celu wykrycia zmian wzmacniających się wcześniej względem otaczającej tkanki stercza czasowa rozdzielczość powinna być mniejsza niż 10 sekund, a nawet mniejsza niż 7 sekund na cykl w celu ujawnienia wczesnego wzmocnienia ogniskowego. Zalecana jest supresja/subtrakcja tłuszczu. Chociaż stosowane mogą być zarówno sekwencje T1 gradientowe (GRE) 2D, jak i 3D, to 3D są preferowane.
Ocena PI-RADS dla DCE 
Zastrzeżenia do DCE DCE zawsze powinno być interpretowane w odniesieniu do obrazów T2-zależnych i DWI; wzmocnienie ogniskowe w klinicznie stwierdzonych rakach zwykle odpowiada zmianom ogniskowym widocznym na obrazach T2-zależnych i/lub DWI. DCE może być przydatne, gdy ocena w DWI części lub całości prostaty jest technicznie utrudniona (tzn. kategoria X) i kiedy ustalany jest priorytet spośród wielu zmian u tego samego pacjenta (np. jeśli wszystkie inne czynniki są równoważne, największa wykazująca największe DCE może być uznana za zmianę główną). Uogólnione pozytywne wzmocnienie w DCE jest zwykle wynikiem procesu zapalnego (np. zapalenia stercza). Nowotwory w stadium naciekania mogą także wykazywać cechy uogólnionego wzmocnienia, tym niemniej jest to rzadkie i zwykle można zaobserwować zmiany na odpowiadających obrazach T2-zależnych i/lub DWI. Bywają przypadki, kiedy histologicznie niewielkie raki stercza współistnieją z prawidłowymi tkankami gruczołu. Mogą być one niewykrywalne na obrazach T2-zależnych i DWI, a okazjonalnie mogą się ujawnić tylko w DCE. Zwykle jednak dotyczy to guzów niskiego stopnia złośliwości, a wzmocnienie w niektórych przypadkach może być wynikiem współistniejącego zapalenia. Komentarz dotyczący multiparametrycznego badania MRIW naszej ocenie zamysł autorów PI-RADS v2, aby przedstawić minimalny protokół badania, który w miarę potrzeb i możliwości w poszczególnych sytuacjach się rozszerza, jest bardzo słuszny. Kolejny krok w kierunku normalizacji protokołu diagnostycznego ułatwia porównywanie badań wykonywanych kolejno u tego samego pacjenta oraz badań przeprowadzanych w różnych ośrodkach. Ma to istotne znaczenie zarówno w praktyce klinicznej, jak i w pracy naukowej. W zupełności zgadzamy się, że ocena musi zawierać obrazy T1-zależne, T2-zależne oraz dyfuzyjne. Naszym zdaniem wyższa rozdzielczość kontrastowa obrazów 2D T2-zależnych jest ze wszech miar pożądana i oszczędność czasu nie powinna w tym przypadku uzasadniać rezygnowania z nich na rzecz obrazów 3D T2-zależnych. Ogólny opis dotyczący obrazowania dyfuzyjnego wymaga w naszym mniemaniu doprecyzowania. PI-RADS v2 nie zawiera informacji na temat zastosowania innych modeli obliczania wartości ADC niż model monowykładniczy. Jak wiadomo, pomiary wartości ADC dokonane na skanerach pochodzących od różnych producentów nie mogą być bezpośrednio porównywalne, jednak PI-RADS v2 nie proponuje użytkownikom żadnej innej alternatywy wiarygodnej ilościowej oceny zmian. Zastosowanie niskich wartości b nie jest szerzej opisane, ma jedynie charakter krótkiej wzmianki, nie wiadomo więc, jakie jest stanowisko autorów PI-RADS v2 w tej kwestii. Słowniczek ADC (apparent diffusion coefficient) - miara dyfuzji cząsteczek wody w obrębie badanej tkanki, wyliczona na podstawie wartości uzyskanych w badaniu dyfuzyjnym (DWI). Brzegi spikularne - określenie morfologii zmiany - igiełkowate, gwiaździste. DCE-MRI(dynamic contrast-enhanced MRI) - metoda obrazowania polegająca na następującym po sobie kilkakrotnym skanowaniu wybranego obszaru po dożylnym podaniu środka kontrastowego. FOV(field of view) - obszar objęty badaniem. SE (sekwencja echa spinowego) - jedna z typowych sekwencji stosowanych w badaniach obrazowych, w której stosuje się parę impulsów 90° i 180°. Tryb cine (kinematograficzny) - tryb szybkiego przewijania umożliwiający obserwowanie napływania środka kontrastowego do określonych obszarów anatomicznych i jego wypłukiwanie. Obrazy T1-zależne - oddające wizualnie strukturę anatomiczną miednicy, bez zróżnicowania na strefy prostaty, umożliwiające uwidocznienie ognisk krwotocznych i zmian przerzutowych w kościach. Obrazy T2-zależne - oddające wizualnie strukturę anatomiczną miednicy, ze szczególnym uwzględnieniem zróżnicowania na strefy prostaty, umożliwiające różnicowanie między guzkami powstającymi w przebiegu łagodnego rozrostu stercza. Voxel (volumetric picture element) - najmniejszy element przestrzeni, trójwymiarowy ekwiwalent piksela. Podobnie jak w poprzedniej części zaznaczona jest wątpliwość autorów PI-RADS v2 co do wartości części badania przeprowadzonej po podaniu środka kontrastowego i trudno jej nie podzielać. Wydaje się, iż teza, że badanie kontrastowe umożliwia wykrycie małych ognisk raka jest sprzeczna z założeniem, że badanie ma być dedykowane wykrywaniu ognisk raka istotnego klinicznie. Przychylamy się do koncepcji, że wydłużenie protokołu badania i zwiększenie jego kosztu spowodowane koniecznością podania środka kontrastowego w wielu przypadkach okazuje się nieuzasadnione i skłaniamy się ku postulatowi, aby środek kontrastowy podawać pacjentom poddawanym wcześniej procedurom terapeutycznym w celu poszukiwania wznowy, nie zaś - jak to ma miejsce obecnie - we wszystkich przypadkach.
Ponadto PI-RADS v2 nie uwzględnia w minimalnym protokole oceny spektroskopowej, chociaż w poprzedniej wersji była ona proponowana jako alternatywa dla obrazowania dyfuzyjnego lub dynamicznego wzmocnienia kontrastowego. Z jednej strony badanie spektroskopowe faktycznie nie jest łatwe do przeprowadzenia, jednak z drugiej strony ma udowodnioną wartość diagnostyczną, zaś jego wynik niejednokrotnie jest rozstrzygający, jeśli chodzi o różnicowanie zmian łagodnych i złośliwych. W naszej ocenie ponowne wprowadzenie oceny spektroskopowej do minimalnego protokołu badania multiparametrycznego jest uzasadnione. Pytanie, czy miałaby to być spektroskopia jedno- czy też wielowokselowa pozostawiamy otwarte, ponieważ obie metody mają swoich zwolenników. Podsumowując, w naszej ocenie ta część PI-RADS v2 jest najbardziej dyskusyjna i wymaga najgruntowniejszej przebudowy oraz uzupełnienia, co - jak przypuszczamy - niebawem nastąpi.
dr n. med Katarzyna Sklinda
lek.Agnieszka Dąbrowska
lek.Paweł Olejnik
prof. dr hab. n. medJerzy Walecki Piśmiennictwo:
35. Marshall VF, Segaul RM. Experience with suprapubic vesicourethral suspension after previous failures to correct stress incontinence in women. J Urol 1968;100:647-648. 36. Hoefner K, Jonas U. Praxisratgeber Harninkontinenz. Uni-Med. Verlag AG, Bremen 2000. 37. Käser O, Ikle FA, Hirsch HA. Atlas der gynäkologischen Operationen. 4.Auflage.G.Thieme, Stuttgart New York 1983. 38. McKiel CF, Graf EC, Callahan DH. Marshall-Marchetti procedure: modification. J Urol 1966; 96:737-739. 39. Shull BL, Baden WF. A six-year experience with paravaginal defect repair for stress urinary incontinence. Am J Obstet Gynecol 1989;160:1432-39. 40. Stanton SL, Monga AK. Clinical Urogynaecology. Churchill Livingstone 2000. 41. Burch J. Urethrovaginal fixation to Cooper's ligament for correction of stress incontinence, cystocele and prolapse. Am J Obstet Gynecol 1961;81:281-90. 42. Burch J. Cooper's ligament urethrovesical suspension for stress urinary incontinence. Am J Obstet Gynecol 1968;100:764. 43. Dainer M, Hall CD, Choe J, Bhatis NN. The Burch procedure: a comprehensive review. Obstet Gynecol Surv 1998;54/1:49-60. 44. Hirsch HA. Operationen zur Behandlung der Stressinkontinenz. Gynäk Rdsch 1979;19 (Suppl 1):62-72. 45. Jolic V. Should Burch colposuspension be replaced by fibrin glue colpofixation in women with urinary stress incontinence? Zentralbl Gynäkol 1996;118:236-238. 46. Stanton SL, Cardozo LD. A comparison of vaginal and suprapubic surgery in the correction of incontinence due to urethral sphincter incompetence. Br J Urol 1979;51:497-499. 47. Mazurek LJ. Wysiłkowe nietrzymanie moczu u kobiet z podaniem własnego sposobu leczenia operacyjnego. Urol Pol 1952;4:38-83. 48. Paraiso MFR, Falcone T, Walters MD. Laparoscopic surgery for genuine stress incontinence. Int Urogynecol J 1999;10:237-247. 49. Buller JL, Cundiff GW. Laparoscopic surgeries for urinary incontinence. Clin Obstet Gynecol 2000;43:604-618. 50. Kemp B, Heyl W, Rath W. Die endoskopischen Kolposuspensionverfahren - eine aktuelle Bestandsaufnahme. Geburtsh u Frauenheilk 1999; 59:275-281 51. Nietrzymanie moczu u kobiet. Konferencja naukowo - szkoleniowa. Tychy 14.12.2001. 52. Koelbl H. Weibliche Stressharninkontinenz - abdominale Methoden. Gyn-Activ 1998. 53. Pelosi MA III, Pelosi MA. Pubic bone suburethral stabilization sling: laparoscopic assessment of a transvaginal operation for the treatment of stress urinary incontinence. J Laparoendoscopic Adv Surg Tech 1999; 9: 45-50. 54. Pereyra AJ. A simplified surgical procedure for the correction of stress incontinence in women. West J Surg 1959; 67: 223-6. 55. Zivkoviv F, Pieber D, Tamussino K, Ralph G. Nadelsuspensionsmethoden für die Behandlung der Stressinkontinenz. Zentralbl Gynäkol 1998; 120: 17-20. 56. Raz S, Sussman EM, Erickson DB, Bregg KJ, Nitti VW. The Raz bladder neck suspension: results in 206 patients. J Urol 1992;148:845-50. 57. Fitzpatrick CC, Mrcog MB, Elkins E, DeLanceyJOL. The surgical anatomy of needle bladder neck suspension. Obstet Gynecol 1996; 87: 44-49. 58. Langer R, Schneider D, Ariely S, Bukovsky I, Caspi E. A new colpo-needle suspension for the surgical treatment of stress incontinence: a 2-year follow-up. Eur Urol 1994;26:258-261. 59. Gilja I. Transvaginal needle suspension operation: the way we do it. Eur Urol 2000; 37: 325-330. 60. Kaplan S.A., Te AE, Young GPH, Andrade A, Cabelin MA, Ikeguchi EF. Prospective analysis of 373 consecutive women with stress urinary incontinence treated with a vaginal wall sling: the Columbia - Cornell University experience. J Urol 2000; 164: 1623-1627. 61. Tebyani N, Patel H, Yamaguchi R, Aboseif S. Percutaneous needle bladder neck suspension for the treatment of stress urinary incontinence in women: long-term results. J Urol 2000; 163: 1510-1512. 62. Alcalay M, Monga A, Stanton SL. Burch colposuspension: a 10-20 year follow up. Br J Obstet Gynaecol 1995; 102: 740-745. 63. Scott FB, Bradley WE, Timm GW. Treatment of urinary incontinence by an implantable prosthetic urinary sphincter. J Urol 1974; 112: 75-80. 64. Thomas K, Venn SN, Mundy AR. Outcome of artificial urinary sphincter in female patients. J Urol 2002; 167: 1720-1722. 65. Herschorn S, Radomski SB. Collagen injections for genuine stress urinary incontinence: patient selection and durability. Int Urogynecol J 1997; 8: 18-24. 66. Klingler HC, Marberger M. Submuköse Schleimhaut - unterfütterung bei intrinsicher Sphinkterinsuffizienz. Urologe 2001; 40: 281-286. 67. Sherif MKM, Foley S, Mcfarlane J, Nauth-Misir R, Shah PJR. Endoscopic correction of intractable stress incontinence with silicone micro-implants. Eur Urol 1997; 32: 284-288. 68. Monga AK, Stanton SL. Urodynamics: prediction, outcome and analysis of mechanism for cure of stress incontinence by periurethral collagen. Br J Obstet Gynecol 1997; 104:158-162. 69. Barranger E, Fritel X, Kadoch O, Liou Y, Pigne A. Results of transurethral injection of silicone microimplants for females with intrinsic sphincter deficiency. J Urol 2000;164:1619-1622. 70. Swami S, Batista JE, Abrams P. Collagen for female genuine stress incontinence after a minimum 2-year follow-up. Br J Urol 1997; 80: 757-61. 71. Su TH, Wang KG, Hsu CY, Wei HJ Yen HJ, Shien FC. Periurethral fat injection in the treatment of recurrent genuine stress incontinence. J Urol 1998; 159: 411-14. 72. Pycha A, Klingler CH, Haitel A, [et al.].Implantable microballoons: an atractive alternative in the management of intrinsic sphincter deficiency. Eur Urol 1998; 33: 469-75. 73. Stenberg A, Laesson G, Johnson P, Heimer P, Ulmsten U. DiHA Dextran Copolymer, a new biocompatible material for endoscopic treatment of stress incontinent women. Acta Obstet Gynecol Scand 1999; 78: 436-442. 74. Aref-Adib M, Lamb BW, Lee HB, [et al.]. Stem cell therapy for stress urinary incontinence: a systematic review in human subjects. Arch Gynecol Obstet 2013; 288: 1213-1221. 75. Rovner ES, Dmochowski RR, Leach GE[et all]. A randomized, controlled clinical trial of a novel intravesical pressure attenuation device for the treatment of stress urinary incontinence. J Urol 2013; 190(6): 2243-2250. |
||||||||
