Cystektomia radykalna - standard operacji we współczesnej
uroonkologii
Radykalne wycięcie pęcherza moczowego (cystektomia radykalna
- CR), obok radykalnego wycięcia nerki i radykalnej prostatektomii,
jest jednym ze sztandarowych operacji w urologii. Operacja
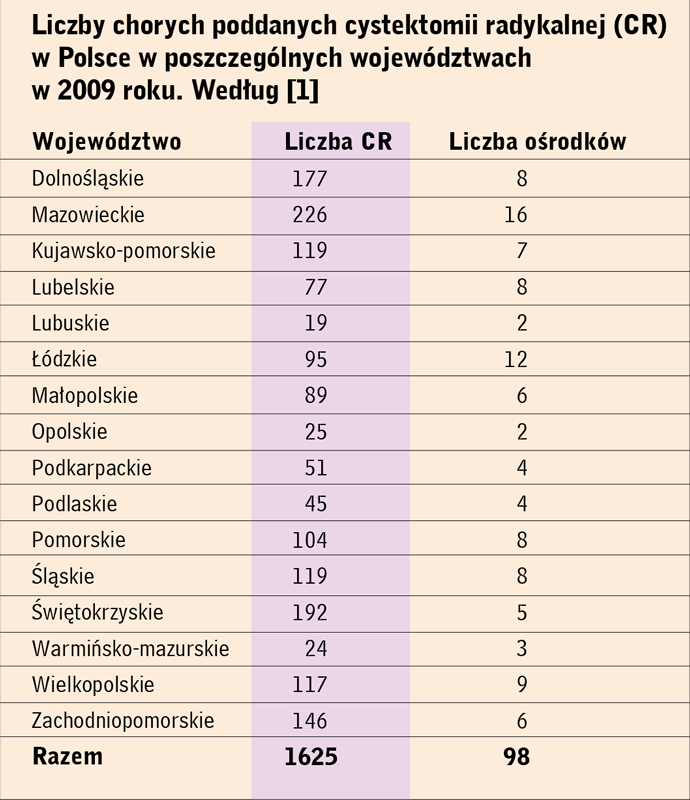
wykonywana jest w Polsce w niemal wszystkich (86%) klinikach
i oddziałach urologicznych w liczbie 1625 rocznie [1] (tab. 1). CR wykonuje
się głównie z powodu inwazyjnego raka pęcherza moczowego
(bladder cancer - BCa) zaawansowanego klinicznie do stopni
T2-T4 (rak naciekający błonę mięśniową pęcherza, muscle
invasive BCa - MIBCa), niemniej wśród osób poddanych tej operacji
zwiększa się odsetek chorych dotkniętych rakiem nienaciekającym
błony mięśniowej (non-muscle invasive BCa - N-MIBCa)
dochodzący do 15% [2], który charakteryzuje się złymi czynnikami
prognostycznymi (T1G3 oraz CIS), głównie nawrotowym po przezcewkowej
elektroresekcji guza (transurethral resection of the bladder
tumor - TURBT) i po BCG-terapii dopęcherzowej. Polskie środowisko
urologiczne nie dysponuje szczegółową znajomością
stopnia zaawansowania nowotworu u chorych poddawanych CR
w naszym kraju i niewiele wiadomo na temat stosowanej techniki
chirurgicznej, częstości i charakteru powikłań pooperacyjnych,
a zwłaszcza wyników leczenia uzyskiwanych po tej operacji (np. przeżycie
całkowite, overall survival - OS; przeżycie swoiste dla raka,
cancer specific survival - CSS).
Opinie klinicystów z różnych części kraju potwierdzają istnienie
fatalnego scenariusza chorobowego w raku pęcherza moczowego
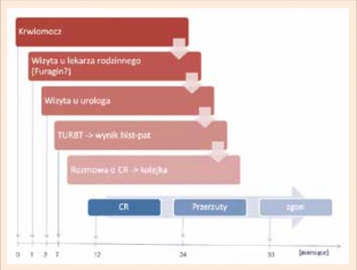
w Polsce, który sprowadza się do następującej sekwencji zdarzeń:
krwiomocz - zwłoka kilku tygodni do czasu zgłoszenia się chorego
do lekarza; lekarz rodzinny/inny - podanie antyseptyku, krótkotrwała
poprawa; nawrót krwiomoczu po kolejnych kilku tygodniach;
ponowna wizyta u lekarza lub ostry dyżur w szpitalu, pierwszy kontakt
z urologiem po upływie 3-6 miesięcy od wystąpienia krwiomoczu,
urolog kieruje do szpitala - wyczekiwanie na przyjęcie
do TURBT, po 2 tygodniach wynik badania histopatologicznego
(h-p), potem często tomografia komputerowa (?!?); kolejne skierowanie
do szpitala; oczekiwanie na operację 3-12 tygodni (a nawet
więcej), po kolejnych 2 tygodniach wynik badania h-p usuniętego
pęcherza i wówczas ewentualne ustalenie wskazań do leczenia adjuwantowego
(ryc. 1). W sumie - kilka miesięcy opóźnienia przed
cystektomią i spore opóźnienie po operacji, w wyniku czego po kilku
miesiącach od operacji rozwijają się przerzuty i następuje zgon.
Odsetek chorych poddanych cystektomii radykalnej, którzy zmarli
w czasie 5 lat od operacji, w materiale własnym sięga blisko 80%.
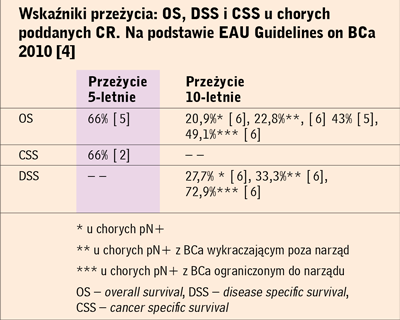
Wyniki dotyczące przeżycia chorych poddanych CR w materiale
własnym oraz publikowane przez pojedyncze polskie ośrodki [3]
(tj. całkowite przeżycie 5-letnie - odpowiednio 21% i 24,6%, mediana
przeżycia 12 i 14 miesięcy) nie korelują z wynikami publikowanymi w literaturze światowej, które mimo iż nie są dobre, wydają
się znacznie bardziej optymistyczne (tab. 2).
|
Liczby chorych poddanych cystektomii radykalnej (CR)
w Polsce w poszczególnych województwach
w 2009 roku. Według 1 |
 |
|
Fatalny scenariusz chorobowy w raku pęcherza moczowego w Polsce |
 |
Wskazania do chemioterapii systemowej (ChTx) - neoadjuwantowej
lub adjuwantowej - stawiane są indywidualnie i dotyczą wybranych
chorych [7]. Trudno byłoby w odniesieniu do CR w obecnych
warunkach mówić o standardzie terapeutycznym oraz określić rzeczywistą
jakość tego standardu mierzoną wiarygodnymi wynikami
onkologicznymi. Potrzebna jest zatem w naszym kraju obiektywna,
krytyczna weryfikacja procesu leczniczego obejmującego wycięcie
radykalne pęcherza moczowego. Na tych przesłankach oparty został
krótki przegląd zagadnień odnoszących się do CR, a stanowiących
treść tego opracowania. Dla uproszczenia podzielono je na dwie
części: wiadomości podstawowe oraz wybrane wątki do dyskusji.
W części pierwszej znalazły się m.in. definicja, wskazania, zakres,
powikłania, wyniki onkologiczne, a w części drugiej - zagadnienie
oceny marginesów chirurgicznych (moczowody, cewka moczowa),
techniki oszczędzające stercz i/lub pęcherzyki nasienne oraz pęczki
naczyniowo-nerwowe, a także zakres limfadenektomii regionalnej
i kontrowersje wokół leczenia oszczędzającego pęcherz u wybranych
chorych na MIBCa. W uzupełnieniu poruszono zagadnienie
cystektomii sanitarnej i ratunkowej oraz przypomniano wytrzewienie
miedniczne. Opracowanie porusza wyłącznie zagadnienia CR,
z konieczności pominięto w nim złożone i oddzielne zagadnienia związane
z odprowadzeniem moczu po wycięciu pęcherza moczowego.
|
Wskaźniki przeżycia: OS, DSS i CSS u chorych
poddanych CR. Na podstawie EAU Guidelines on BCa
2010 4 |
 |
|
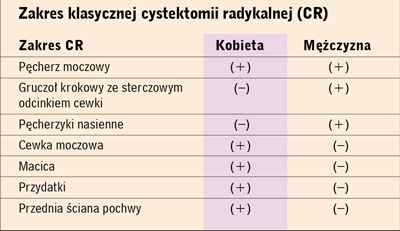
Zakres klasycznej cystektomii radykalnej (CR) |
 |
Część I
Cystektomia radykalna - wiadomości podstawowe
Definicja
Cystektomia radykalna jest standardem leczenia raka pęcherza zaawansowanego
miejscowo, naciekającego błonę mięśniową pęcherza.
Operacja obejmuje usunięcie pęcherza moczowego i narządów
z nim bezpośrednio sąsiadujących, czyli gruczołu krokowego
i pęcherzyków nasiennych u mężczyzn, a cewki moczowej, macicy,
przydatków i przedniej ściany pochwy u kobiet [4] (tab. 3, ryc. 2).
Konieczność usunięcia całego stercza u mężczyzn, a także zakres
uretrektomii i resekcji pochwy u kobiet były ostatnio kwestionowane.
Opisywano w literaturze różne techniki cystektomii oszczędzającej
stercz u wybranych mężczyzn dotkniętych rakiem ograniczonym
do narządu.
Wskazania
Zaleca się wykonywanie CR u chorych na raka naciekającego błonę
mięśniową ściany pęcherza moczowego w stadium T2-T4a, N0-Nx,
M0 [4]. Inne wskazania to rak nienaciekający dużego ryzyka: nawrotowy,
oporny na BCG-terapię rak śródnabłonkowy (carcinoma
in situ - CIS) i rak T1G3, jak również rozległy brodawczakowaty
guz pęcherza, którego nie da się usunąć przezcewkowo. Cystektomia
ratunkowa (salvage cystectomy) ma zastosowanie w przypadku nawrotu
raka inwazyjnego leczonego wcześniej metodą oszczędzającą
pęcherz, np. metodą radioterapii, zaś cystektomię paliatywną
(„sanitarną”) wykonuje się w celu wyeliminowania powikłań miejscowych
nowotworu (np. uporczywy, nie dający się opanować
krwiomocz, znacznie nasilone dolegliwości ze strony dolnych dróg
moczowych, przetoki o charakterze nowotworowym) u chorych,
u których zaawansowanie raka pęcherza jest zbyt duże, by można
było go usunąć radykalnie.
Jeśli chodzi o sposób usunięcia pęcherza, należy przestrzegać reguły
agresywnego wycięcia pęcherza wraz z możliwie szerokim
marginesem tkanek otaczających i narządami sąsiednimi (stercz,
pęcherzyki nasienne, przednia ściana pochwy, macica, jajowody
i jajniki, dystalne odcinki moczowodów, cewka moczowa, regionalne
węzły chłonne).
|
Zakres klasycznej cystektomii radykalnej (CR) |
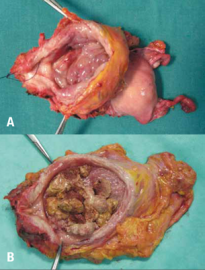 |
Powikłania
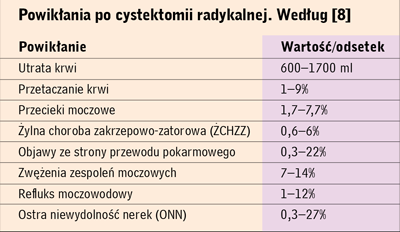
Spośród najczęstszych powikłań występujących po CR należy wymienić:
krwawienie, zatorowość płucną, niedrożność przewodu
pokarmowego, przeciekanie moczu, chłonkotok, zakażenie uogólnione,
zwężenie moczowodu [8] (tab. 4). Trudno jest dokładnie
prześledzić odsetek powikłań typowych dla CR, ponieważ operacja
związana jest ściśle z odprowadzeniem moczu, które jest odpowiedzialne
za dominującą część powikłań w okresie pooperacyjnym.
Utrata krwi jest wybitnie niejednakowa, wynosi w piśmiennictwie
od 600 do 1700 ml, podczas gdy w materiale własnym nie przekracza
1000 ml i wynosi średnio około 300 ml. Lawrentschuk i wsp.
opublikowali ostatnio na łamach European Urology unikalny materiał
dydaktyczno-kliniczny, w którym przedstawili wyczerpujący
przegląd sposobów skutecznej prewencji powikłań śród- i pooperacyjnych
związanych z CR [8] (tab. 5).
|
Zakres klasycznej cystektomii radykalnej (CR) |
 |
|
Zakres klasycznej cystektomii radykalnej (CR) |
 |
Śmiertelność
W jednym z ostatnich badań długoterminowych, opartym na obserwacji
1054 chorych, śmiertelność w okresie okołooperacyjnym
wyniosła 3%, a powikłania wczesne (występujące w okresie 3 miesięcy
od CR) stwierdzono u 28% operowanych [9, 10]. A zatem CR
jest zabiegiem bezpiecznym. Powikłania późne związane są zwykle
z odprowadzeniem moczu. Częstość występowania powikłań
wczesnych po CR wykonanej z powodu raka nienaciekającego oraz
z powodu raka naciekającego błonę mięśniową jest podobna [11].
Śmiertelność okołooperacyjna i częstość występowania powikłań
są mniejsze w ośrodkach, w których liczby chorych poddanych CR
są duże, niż w ośrodkach, w których operację tę wykonuje się stosunkowo
rzadko [12]. Warto podkreślić, iż w ośrodkach wyspecjalizowanych
śmiertelność nie wzrasta wraz z wiekiem chorych operowanych
i u chorych w wieku powyżej 80 lat nie przekracza 2,8%.
Przeżycie chorych
Wiarygodnych danych na temat przeżycia chorych po CR jest niewiele.
Do zgonu dochodzi zwykle w pierwszych 3-5 latach po operacji.
Według pracy Tollefsona i wsp. (Mayo Clinic) spośród 1397
chorych poddanych CR w latach 1980-1998 (18 lat) 1082 (77%)
zmarło średnio po upływie 3,6 roku od operacji [13]. W niektórych
ośrodkach amerykańskich uzyskano przeżycie swoiste dla raka
(CSS) na poziomie 66%, a przeżycie wolne od wznowy (RFS) - 58% [2].
W Europie Zachodniej 5-letnie przeżycie całkowite po CR wykonanej
z powodu raka ograniczonego do pęcherza (T1, T2) wynosi
68%, zaś po CR wykonanej z powodu raka przekraczającego ścianę
pęcherza (T3, T4) nie więcej niż 30% [14]. Wynik onkologiczny CR
zależy nie tylko od stopnia miejscowego zaawansowania guza (T),
ale także od stanu miednicznych węzłów chłonnych. Hautmann
uzyskał 5-letnie przeżycie wolne od wznowy (PFS) jedynie 20% chorych,
u których stwierdzono przerzuty do węzłów chłonnych [15].
Niejednakowe wskaźniki wyleczenia mogą również wynikać z różnic
metodologicznych w ocenie wyników, bowiem w niektórych
publikacjach do oceny rezultatów onkologicznych stosuje się przeżycie
całkowite (overall survival - OS), w innych przeżycie swoiste
dla nowotworu (cancer specific survival - CSS) lub przeżycie swoiste
dla choroby (disease specific survival - DSS), wreszcie nierzadko
przeżycie wolne od wznowy (recurrence free survival - RFS).
Warto podkreślić, że nawet wśród populacji krajów wysoko rozwiniętych
istnieją różnice dotyczące zdrowotności, zapadalności,
chorobowości czy organizacji ochrony zdrowia, które należą do czynników
wpływających na zmienność wskaźników epidemiologicznych
na tyle istotnie, że porównywanie wyników leczenia w oparciu
o różne parametry onkologiczne nie jest możliwe.
Zakłada się, że agresywna natura choroby oraz stopień zaawansowania
nowotworu w chwili operacji determinują wynik leczenia,
choć dane literaturowe dotyczące tego zagadnienia nie są jednoznaczne.
Brakuje na przykład analiz badających zagadnienie wpływu
elektroresekcji przezcewkowej guza pęcherza wykonywanej zawsze
przed cystektomią na wynik leczenia radykalnego. Ponadto
obecnie osiągalne wyniki odległe u wybranych chorych poddawanych
neoadjuwantowej chemioterapii są na tyle zachęcające, że coraz
więcej ośrodków wprowadza taki właśnie schemat leczenia
w postaci standardu terapeutycznego
Rekomendacje EAU 2010 [4]
Zaleca się wykonywanie CR u chorych z rakiem w stadiach T2-T4a,
N0-NX, M0 oraz w przypadkach N-MIBC wysokiego ryzyka [4].
Usunięcie węzłów chłonnych powinno być integralnym elementem
CR, ale zasięg limfadenektomii nie został dotąd jednoznacznie
określony. Oszczędzenie cewki moczowej jest możliwe, jeśli śródoperacyjne
badanie histopatologiczne wykaże, że marginesy chirurgiczne
są ujemne, a stan cewki moczowej będzie systematycznie
kontrolowany po operacji. Do tego celu zaleca się stosowanie badania
cytologicznego popłuczyn uzyskanych z cewki oraz uretroskopię.
Podsumowanie
Radykalne wycięcie pęcherza moczowego u obojga płci jest często
wykonywaną operacją obarczoną - co wynika z analizy publikacji
pochodzących spoza Polski - niską śmiertelnością (poniżej 3%),
wysokim odsetkiem powikłań pooperacyjnych (powikłania mniejszej
rangi od 20% do ponad 60%; powikłania poważne 5-25%; jedno
lub więcej powikłań dotyczy ponad 50% operowanych), a także
wysoce niesatysfakcjonującymi wynikami onkologicznymi - przeżycie
całkowite (OS) poniżej 50%, przeżycie swoiste dla raka (CCS)
do 60%.
Nasuwa się pytanie, dlaczego tak jest i jakie czynniki determinują
ostateczny wynik leczenia. Pierwszym z nich jest z pewnością
agresywna natura raka przejściowonabłonkowego, drugim ważnym
czynnikiem jest sama operacja. Tutaj rodzi się kolejne pytanie:
czy i jak można poprawić jakość (doszczętność) radykalnego wycięcia
pęcherza moczowego z powodu raka? O wybranych zagadnieniach
wpływających na jakość chirurgicznego leczenia radykalnego
traktuje druga część niniejszego opracowania.
Część II
Czynniki definiujące jakość CR, które mogą tłumaczyć
dużą częstość niepowodzeń
Do tych czynników należą:
- Zagadnienia związane z upływem czasu (od chwili rozpoznania
raka do wycięcia pęcherza)
- Zakres limfadenektomii regionalnej
- Ocena marginesów chirurgicznych (moczowody,
cewka moczowa), rola badania doraźnego
- Rak incydentalny stercza (nowotwory: gruczolakorak stercza
i rak urotelialny w sterczu)
- Techniki oszczędzające stercz (prostate sparing) i/lub pęcherzyki nasienne (seminal vesicle sparing) czy pęczki
naczyniowo-nerwowe (nerve sparing)
- Kontrowersje wokół częściowego wycięcia pęcherza
- Cystektomia sanitarna i ratunkowa (salvage cystectomy)
- Wytrzewienie miedniczne (pelvic exenteration)
|
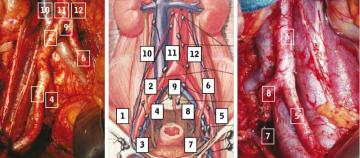
Zakres rozszerzonej limfadenektomii miednicznej 12. 1 - t. biodrowa zewnętrzna, prawa; 2 - t. biodrowa wspólna, prawa; 3 - dół zasłonowy prawy; 4 - t. biodr owa
wewnętrzna, prawa; 5 - t. biodrowa zewnętrzna, lewa; 6 - t. biodrowa wspólna, lewa; 7 - dół zasłonowy, lewy; 8 - t. biodrowa wewnętrzna, lewa; 9 - rozdwojenie aorty;
10 - ww. chłonne okołokawalne; 11 - ww. chłonne pomiędzy aortą i żyłą główną dolną; 12 - ww. chłonne okołoaortalne. Źródło: European Urology Supplement 9 (2010)
419-423. Anatomoc Extent of Pelvic Lymphadenectomy in Bladder Cancer. A. Heidennich, D. Pfister |
 |
Zagadnienia związane z upływem czasu (od chwili rozpoznania
do wycięcia pęcherza)
Istotny, niekorzystny wpływ upływu czasu „straconego” podczas
terapii wstępnej (przed cystektomią) na wyniki leczenia radykalnego
wykazano jednoznacznie w wielu badaniach retrospektywnych.
Między innymi Herr i wsp. wykazali, że znacznie lepsze wyniki CR
osiąga się u chorych leczonych z powodu raka nieinwazyjnego nieodpowiadającego
na BCG-terapię, o ile czas leczenia zachowawczego
jest krótszy niż 2 lata [16, 17]. Z kolei Chang i wsp. udowodnili,
że opóźnienie CR o ponad 3 miesiące skutkuje wzrostem
odsetka raków bardziej zaawansowanych (ponad T2) z 50% do 80%
[11], co w oczywisty sposób pogarsza rokowanie.
W retrospektywnym badaniu, które objęło 153 chorych ze wskazaniami
do radykalnego leczenia chirurgicznego miejscowo zaawansowanego
raka pęcherza moczowego, opóźnienie w leczeniu ponad
90 dni od pierwotnego rozpoznania prowadziło do wzrostu
częstości występowania choroby wykraczającej poza pęcherz [17].
Opóźnienie w wykonaniu cystektomii wpływa nie tylko na wyniki
onkologiczne leczenia, ale także na rodzaj zastosowanego odprowadzenia
moczu po CR. W stadium BCa ograniczonym od narządu
średni czas od pierwotnego rozpoznania do cystektomii wyniósł
12,2 miesięcy w grupie chorych, u których wytworzono pęcherz
ortotopowy i 19,1 miesięcy w grupie z ileal conduit [18]. U chorych
z rakiem inwazyjnym różnica ta była jeszcze bardziej jaskrawa -
wynosiła 12 miesięcy, tj. u pacjentów, u których wytworzono pęcherz
ortotopowy, średni czas do operacji wyniósł 3,1, a w grupie
ileal conduit - 15,1 miesiąca [18]. Podobne wyniki obserwowano
w badaniu na 247 pacjentach, gdzie kryterium wystąpienia znamiennie
gorszych wyników odległych stanowi granica 90 dni od chwili
rozpoznania do CR [19]. Wniosek: należy działać wcześnie (np. w ciągu
najwyżej 2 lat BCG-terapii) i szybko (do 3 miesięcy) od chwili
postawienia rozpoznania wskazującego na konieczność radykalnego
wycięcia pęcherza moczowego.
|
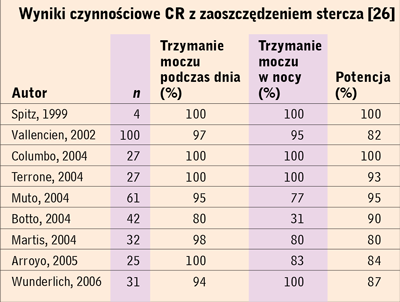
Wyniki czynnościowe CR z zaoszczędzeniem stercza 26 |
 |
Zakres limfadenektomii regionalnej -
limfadenektomia lecznicza
CR obejmuje także wycięcie regionalnych węzłów chłonnych. Dostępna
jest znaczna liczba publikacji dotyczących zakresu limfadenektomii.
Jednakże dane dotyczące znaczenia klinicznego tych odkryć
są nadal kontrowersyjne [4]. W badaniach retrospektywnych
rozszerzona limfadenektomia (usunięcie węzłów zasłonowych,
wewnętrznych, zewnętrznych, wspólnych biodrowych i przedkrzyżowych,
jak również węzłów rozwidlenia aorty) była wymieniana
jako poprawiająca przeżycie chorych z rakiem pęcherza moczowego
naciekającym mięśniówkę. Wartość lecznicza usunięcia
węzłów chłonnych jest nadal nieznana, a standaryzowana limfadenektomia
nie jest jednoznacznie zdefiniowana. Dostępne są wiarygodne
wyniki badań dotyczące lokalizacji węzłów chłonnych zajętych
przez ogniska raka, które wykazały zarówno retro-, jak i
prospektywnie, że węzły chłonne u chorych z rakiem pęcherza moczowego
nie są znajdywane poza miednicą, jeśli węzły miednicy
są wolne od nowotworu. Co więcej, przeżycie wolne od progresji,
jak również całkowite przeżycie mogą być skorelowane z liczbą węzłów chłonnych usuniętych podczas CR. Usunięcie więcej niż 15 węzłów
wydaje się być wystarczające zarówno do oceny stanu zajęcia
węzłów, jak i korzyści w kategorii całkowitego przeżycia na podstawie
wyników badań retrospektywnych. Wynik leczenia koreluje z zajęciem
węzłów i jest dwukrotnie gorszy u chorych, u których węzły
chłonne okazały się zajęte przez raka (OS 20% względem 40%).
Limfadenektomia lecznicza podczas cystektomii radykalnej obejmuje
tkankę chłonną zawierającą ponad 15 węzłów chłonnych pobraną
obustronnie, począwszy od dołów zasłonowych do rozwidlenia
aorty [20] (ryc. 3).
|
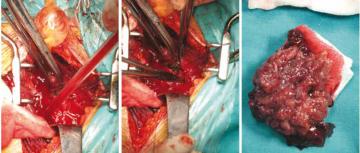
Zdjęcia śródoperacyjne: częściowe wycięcie pęcherza moczowego z powodu guza powierzchownego, który nie mógł być usunięty na dr odze przezcewkowej
materiał własny |
 |
Ocena śródoperacyjna marginesów chirurgicznych
podczas CR (badanie doraźne)
Większość urologów jest zdania, że dystalny odcinek moczowodu
(jego długość nie jest jednoznacznie określona) powinien być usuwany
podczas CR, ale jedynie w przypadku CIS pęcherza konieczne
jest badanie śródoperacyjne mrożonych skrawków dystalnego
odcinka moczowodu dla oceny marginesów chirurgicznych. Warto
pamiętać, iż jedynie w 8% przypadków udowodniono zajęcie moczowodu
w dużej serii preparatów po CR [21]. Większość ośrodków
z dużym doświadczeniem stosuje ocenę śródoperacyjną marginesu
cewkowego przed podjęciem decyzji o nieusuwaniu cewki
moczowej oraz o sposobie odprowadzenia moczu po CR. Warunkiem
zachowania cewki i odprowadzenia ortotopowego jest ujemny
margines chirurgiczny cewki oceniony śródoperacyjnie. Niektórzy
uważają, że można nie oceniać stanu cewki doraźnie m.in. z powodu
niewystarczającej jakości badania, ale wówczas powinno się posłać
margines cewkowy do standardowego badania patomorfologicznego
po operacji. W większości przypadków przed operacją
dysponuje się wiarygodną oceną stanu patomorfologicznego cewki
sterczowej w oparciu o biopsję mappingową cewki wykonaną uretroskopowo.
Uretrektomia
Zaleca się wykonywanie uretrektomii jedynie wówczas, jeśli występują
dodatnie marginesy chirurgiczne na poziomie cięcia cewki,
dodatnie marginesy w preparacie pęcherza (u obu płci), jeśli pierwotny
nowotwór jest zlokalizowany w szyi pęcherza lub w cewce
(kobiety) lub jeśli guz znacząco nacieka stercz. W pozostałych
przypadkach cewkę należy pozostawić. W razie takiej konieczności
wynikającej z podejrzenia wznowy, albo niekorzystnego wyniku
badania histopatologicznego po operacji, należy ją usunąć w drugim
etapie. Warto tutaj przytoczyć interesujące, choć bardzo kontrowersyjne
doniesienie Freemana, który stwierdził, że częstość
wznowy cewkowej u chorych z odprowadzeniem ortotopowym
poddanych CR jest mniejsza niż w grupie ileal conduit, co miałoby
wynikać z protekcyjnego oddziaływania moczu i/lub przepływu
moczu na cewkę [22]. Jak dotąd nikt nie potwierdził tej hipotezy
ani nikt inny nie opublikował podobnej obserwacji.
Rak incydentalny stercza
Rak gruczołowy stercza
Badania autopsyjne oraz badania nad występowaniem raka stercza
w preparatach po cystoprostatektomii wykonanej z powodu raka
pęcherza moczowego wskazują, że u około 23-54% pacjentów
znajdowano ogniska raka gruczołowego stercza [23, 24]. Do 29%
tych nowotworów ma znaczenie kliniczne, u niektórych chorych
dochodzi do nawrotu miejscowego lub nawet przerzutów [24].
Rak przejściowonabłonkowy w sterczu
Co więcej, rak urotelialny w sterczu wykrywany był u 33% pacjentów
poddanych radykalnej cystoprostatektomii [25]. W innym badaniu
w 41% preparatów z cystoprostatektomii wykazano obecność
niespodziewanego raka stercza, z czego 48% guzów miało
znaczenie kliniczne. W sumie, we wspomnianych badaniach jedynie 26-33% pacjentów poddanych cystoprostatektomii z powodu
raka pęcherza moczowego nie miało ani raka stercza, ani sterczowego
raka urotelialnego w preparacie.
|
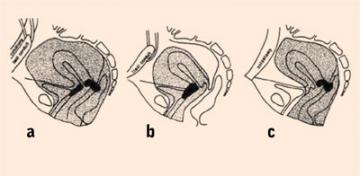
Zakres operacji wytrzewienia miednicznego: a) całkowite, b) przednie,
c) tylne. Według 30 |
 |
Techniki oszczędzające stercz (prostate sparing)
i/lub pęcherzyki nasienne (seminal vesicle sparing)
czy pęczki naczyniowo-nerwowe (nerve sparing)
Możliwość zaoszczędzenia funkcji seksualnych i poprawy trzymania
moczu po CR to jedno z najbardziej kontrowersyjnych zagadnień
współczesnej urologii.
Oczywista potrzeba ograniczenia mocno wpływu CR na stan zdrowia
i jakość życia chorych, szczególnie mężczyzn, w kontekście pooperacyjnej
impotencji oraz zaburzeń trzymania moczu, stymuluje
chirurgów do poszukiwania sposobów zaoszczędzenia pęczków
naczyniowo-nerwowych odpowiedzialnych za zachowanie wzwodu
prącia. Zwolennicy tej koncepcji argumentują, że obawa chorego
przed konsekwencjami operacji w postaci impotencji i gubienia
moczu (nawet przy rekonstrukcji ortotopowej) może być odpowiedzialna
za odraczanie terminu operacji, co pośrednio wpływa na
pogorszenie wyników leczenia [26] (tab. 6). Koncepcja operacji
oszczędzających nerwy (nerve sparing surgery) opiera się na wiedzy
uzyskanej w dziedzinie radykalnej prostatektomii w wersji nerwooszczędzającej
i polega na ominięciu zakresem resekcji tylno-
-bocznego aspektu stercza obustronnie wraz z jego wierzchołkiem
(prostate sparing), pęcherzykami nasiennymi (seminal vesicle sparing)
lub wybiórczo samych pęczków obu-/jednostronnie (nerve
sparing). Udowodniono, że tak przeprowadzona operacja w sposób
statystycznie istotny sprzyja zachowaniu funkcji seksualnych u 60-
80% operowanych i w praktyce zapewnia (90-100%) pełne trzymanie
moczu (tab. 6). Brak jest jednak jednoznacznych danych na temat
wyników onkologicznych w grupie operowanych tą techniką.
Istnieje wiele argumentów przemawiających przeciwko zbytniej
popularyzacji techniki nerve sparing/prostate sparing podczas CR.
Głównym argumentem przeciw stosowaniu tej techniki jest pogląd,
że z oczywistych powodów anatomicznych zabieg przeprowadza
się „kosztem” radykalności onkologicznej. Rozwój technik minimalnie
inwazyjnych, jak cystektomia laparoskopowa czy cystektomia
laparoskopowa
z zastosowaniem robota, mogą w przyszłości oddalić
ten argument. Ponadto niewielu autorów jednoznacznie precyzuje
swoją technikę operacyjną nerve sparing, stąd indywidualne różnice
metod proponowanych przez różnych autorów i trudność w ich
naśladowaniu. Większość światowych autorytetów w dziedzinie CR
(Hautmann, Studer, Skinner) do tej koncepcji odnosi się co najwyżej
nieufnie, co dodatkowo oddala perspektywę uznania jej za standard
w jakimkolwiek wskazaniu onkologicznym.
Warto więc przyjąć, że cystektomia typu nerve sparing jest możliwa
technicznie, wymaga dużej wprawy chirurgicznej i powinna być
rezerwowana dla chorych, którym pęcherz usuwa się z przyczyn
nieonkologicznych lub w wyjątkowych przypadkach raka niskiego
ryzyka o niskim stopniu złośliwości, np. G2.
Częściowe wycięcie pęcherza moczowego
Rak pęcherza moczowego, który jest pojedynczy, pierwotny, zlokalizowany
poza trójkątem pęcherza i poza cewką tylną, który można wyciąć z marginesem minimum 2 cm, może zostać usunięty w drodze
resekcji pęcherza moczowego wraz z guzem [4]. Strategia leczenia
nazywana bywa również leczeniem z zaoszczędzeniem pęcherza,
tzw. bladder sparing therapy. Postępowanie chirurgiczne nie odbiega
od standardowej techniki nadtrójkątowego wycięcia pęcherza i jest
z reguły uzupełniane chemioterapią oraz radioterapią adjuwantową.
Częściowe wycięcie pęcherza można zastosować z powodzeniem
w wyjątkowych sytuacjach, kiedy nie można wyciąć guza powierzchownego
na drodze przezcewkowej (ryc. 4). W obserwacji autora
znajduje się czworo chorych, u których zastosowano taką technikę
z powodzeniem, i u których nie stwierdza się cech wznowy/progresji
nowotworu w okresie kilkuletniej obserwacji.
Szczególną sytuacją kliniczną uzasadniającą odstąpienie od klasycznej
cystektomii radykalnej jest stosunkowo rzadki niezaawansowany
lokalnie rak gruczołowy rozwijający się z resztek moczownika
(urachal cancer), który w wybranych przypadkach może być
przedmiotem częściowego wycięcia pęcherza moczowego wraz
z guzem.
Cystektomia ratunkowa (salvage cystectomy) i paliatywna
Pojęcie cystektomii ratunkowej (salvage) pochodzi z czasów, kiedy
pęcherz usuwano chirurgicznie z powodu niepowodzenia po radioterapii
wykonanej uprzednio [4]. Z czasem, wobec ograniczonej
liczby chorych poddawanych takiej terapii, pojęcie straciło pierwotne
znaczenie, stając się synonimem leczenia ostatniej szansy -
leczenia paliatywnego, podejmowanego w celu zapobieżenia fatalnym
konsekwencjom lokalnej progresji nowotworu. Od tego czasu
pojęcie salvage cystectomy oznacza cystektomię sanitarną, której
celem nie jest wyleczenie z raka (w odróżnieniu od radykalnej
cystektomii,
której celem jest eliminacja choroby), ale prewencja
progresji lokalnej i jej skutków, tj. ograniczenie bólu, krwotoków,
definitywnego uniedrożnienia dróg moczowych itp. Operacja ratunkowa
wydaje się uzasadniona w stadium T3b-T4a, ale nie T4b.
Pierwotna CR u chorych z rakiem pęcherza moczowego w stadium
T4b (raki naciekające miednicę lub ścianę jamy brzusznej) nie jest
opcją leczniczą. Możliwe powikłania zabiegu i jakość życia chorego
powinny być każdorazowo brane pod uwagę przed podjęciem
leczenia chirurgicznego. Takie leczenie w stadium raka zaawansowanego
lokalnie nie przynosi korzyści w kategoriach przeżycia. Leczenie
takich pacjentów nadal pozostaje wyzwaniem i z reguły są
oni kandydatami do paliatywnej radioterapii. Nieoperacyjne, miejscowo
zaawansowane nowotwory mogą wywoływać szereg objawów
wpływających znacząco na funkcjonowanie i jakość życia chorego
terminalnego, takich jak krwawienie, ból, dolegliwości
dyzuryczne
lub zatrzymanie moczu. Istnieje wiele możliwości
leczniczych do zastosowania u chorych z podobnymi objawami.
W zaawansowanych rakach pęcherza moczowego powikłanych
krwawieniem,
cystektomia z odprowadzeniem moczu należy do metod
najbardziej inwazyjnych, a nawet groźnych. Agresywna operacja
daje największą liczbę powikłań okołooperacyjnych i powinno
się ją rozważać tylko wówczas, jeśli nie ma żadnych innych opcji
terapeutycznych. Zebic i wsp. (2005) poddali retrospektywnej analizie
pacjentów ≥75 lat, u których wykonano CR z intencją albo wyleczenia,
albo opieki paliatywnej [27]. Wskazaniami do paliatywnej
cystektomii były zaawansowane nowotwory miednicy z poważnymi
objawami podrażnieniowymi, silnym bólem i nawracającym
krwiomoczem makroskopowym wymagającym przetoczeń krwi.
Autorzy we wnioskach uznali, że starsi ludzie obciążeni są większym
ryzykiem okołooperacyjnych powikłań i śmiertelności,
szczególnie zaś ci z zaawansowanymi chorobami nowotworowymi wywodzącymi się z miednicy, którzy mieli wykonaną paliatywną
cystektomię. Zaawansowany rak pęcherza naciekający błonę mięśniową
może doprowadzić do zatrzymania odpływu moczu [4].
W inwazyjnych nowotworach mechanizm obstrukcji jest zwykle
wywołany łącznie przez blokadę mechaniczną oraz naciek ujść
przez komórki nowotworowe, zaburzający perystaltykę moczowodów.
Obustronne zajęcie moczowodów lub jednostronne zajęcie
moczowodu jedynej czynnej nerki może doprowadzić do pozanerkowej
niewydolności nerek. Leczenie takich pacjentów nadal pozostaje
dylematem medycznym. El-Tabey i wsp. retrospektywnie
przeanalizowali dane pacjentów, którzy leczeni byli z powodu inwazyjnego
raka pęcherza moczowego z towarzyszącą niewydolnością
nerek [28]. Pacjenci z nieoperacyjnymi zaawansowanymi rakami
pęcherza (23 chorych; 37,7%) leczeni byli nefrostomią założoną
na stałe. Cystektomia nie była u tych chorych brana pod uwagę.
10 chorych (26,3%) zostało poddanych paliatywnej cystektomii bez
limfadenektomii, która została wykonana z powodu zaawansowanego
zajęcia węzłów chłonnych u 4 chorych i z powodu miejscowo
zaawansowanej choroby naciekającej ścianę miednicy u kolejnych
6 pacjentów. U wszystkich 10 operowanych pacjentów miejscowa
wznowa w miednicy została rozpoznana już w pierwszym roku obserwacji.
W innym badaniu przedstawiono wyniki pooperacyjne
pierwotnej cystektomii sanitarnej wykonanej u 20 chorych z rakiem
pęcherza w stadium T4 (spośród których 7 było w stadium
T4b) [29]. We wnioskach podkreśla się, że pierwotna cystektomia
wykonywana z powodu raka pęcherza w stadium T4 była technicznie
możliwa oraz cechowała się akceptowalnym odsetkiem powikłań
i śmiertelności okołooperacyjnej.
Wytrzewienie miedniczne (pelvic exenteration)
Wytrzewienie miedniczne zaproponowane w literaturze przez
Brunschwiga w 1948 roku uchodzi nadal za „najbardziej radykalne,
jak dotąd, postępowanie chirurgiczne w raku zlokalizowanym w miednicy
mniejszej” [30, 31]. Według współczesnych danych wskaźniki
śmiertelności pooperacyjnej wynoszą od 3% do 5%, a poważne powikłania
dotyczą 30-44% operowanych [32-34]. Jednak całkowite
5-letnie przeżycie chorych, którzy przebyli takie leczenie, sięga
od 20% do nawet 60%. Wszelkie nowotwory złośliwe zlokalizowane
w tej okolicy, a więc rak odbytnicy, pęcherza moczowego czy narządu
rodnego, są leczone wielodyscyplinarnie różnymi metodami,
m.in. z zastosowaniem radioterapii. W razie niepowodzenia, jako
leczenie ostatniej szansy, oferuje się chirurgiczne usunięcie wszystkich
narządów miednicy mniejszej w jednym preparacie. Opisywano
tzw. odjęcie przednie (pęcherz i narząd rodny), tylne (odbytnica
i narząd rodny) lub całkowite (pęcherz, narząd rodny i odbytnica)
(ryc. 5) [30].
W pewnych warunkach jedyną możliwością wyleczenia jest całkowite
wycięcie zajętych narządów razem z ogniskiem nowotworu.
Pozyskanie jednoznacznie dodatniego wyniku biopsji ma zasadnicze
znaczenie przed podjęciem leczenia chirurgicznego. Warto
stosować tę metodę u chorych, którzy kwalifikują się do tak rozległego
zabiegu, a ten może przynieść szansę na wyleczenie. W wyjątkowych
sytuacjach wytrzewienie może mieć z założenia charakter
operacji paliatywnej, np. w przypadkach raka wywołującego
mnogie przetoki pomiędzy przewodem pokarmowym, drogami
moczowymi i narządem rodnym (klinicznie tzw. zespół kloaki). Za
przeciwwskazania bezwzględne do wytrzewienia miednicznego
uznaje się przerzuty do jamy otrzewnej, jelit oraz obecność przerzutów
odległych, np. obustronnych przerzutów do płuc.
Podsumowanie
Cystektomia radykalna to podstawowa operacja urologiczna, która
mimo zornej prostoty okazuje się zagadnieniem złożonym i trudnym,
na dodatek wymagającym ciągłego doskonalenia ze strony
każdego urologa. W tym celu środowisko urologiczne w Polsce powinno
dysponować centralnym rejestrem chorych poddanych CR,
dla określenia rzeczywistej wartości chirurgicznego leczenia radykalnego
raka pęcherza moczowego w Polsce oraz ukierunkowania
postępu w tej dziedzinie na przyszłość. Wobec braku zainteresowania
tym zagadnieniem ze strony organizatorów ochrony zdrowia
wydaje się uzasadnione oczekiwanie stworzenia takiego narzędzia
przez struktury towarzystwa naukowego, jakim jest Polskie Towarzystwo
Urologiczne. Życzeniem autorów byłoby, aby niniejszy wykład
stał się skuteczną inspiracją w tym kierunku.
dr n. med. Artur A. Antoniewicz, FEBU
Klinika Urologii CMKP, I Zespół Dydaktyki Urologicznej,
Oddział Urologii Międzyleskiego Szpitala Specjalistycznego w Warszawie
kierownik kliniki: prof. dr hab. n. med. Andrzej Borówka
lek. med. Łukasz Zapała
Oddział Urologii Międzyleskiego Szpitala Specjalistycznego w Warszawie
kierownik kliniki: prof. dr hab. n. med. Andrzej Borówka
Artykuł powstał na podstawie wykładu pod tym samym tytułem, wygłoszonego podczas
10. Kursu Szkoły Urologii Komitetu Edukacji PTU, pt. „Naciekający rak pęcherza moczowego”,
odbywającego się w czasie 40. Kongresu Naukowego PTU w Bydgoszczy w czerwcu 2010.
Piśmiennictwo
- Borówka, A., Archiwum Konsultanta Krajowego w dziedzinie urologii. 2009.
- Shariat, S.F., et al., Outcomes of radical cystectomy for transitional cell carcinoma of the bladder: a contemporary series from the Bladder Cancer Research Consortium. J Urol, 2006. 176(6 Pt 1): p. 2414-22; discussion 2422.
- Lemiński, A., M. Słojewski, and A. Sikorski, Przeżycie chorych z naciekającym rakiem pęcherza moczowego poddanych cystektomii. Urol Pol, 2006. 59(3).
- Stenzl, A. and e. al., Guidelines on Muscle-invasive and Metastatic Bladder Cancer. EAU Guidelines, 2010.
- Stein, J.P., et al., Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J Clin Oncol, 2001. 19(3): p. 666-75.
- Gschwend, J.E., P. Dahm, and W.R. Fair, Disease specific survival as endpoint of outcome for bladder cancer patients following radical cystectomy. Eur Urol, 2002. 41(4): p. 440-8.
- Kołaczyk, W., et al., Ocena wpływu systemowej chemioterapii przedoperacyjnej i pooperacyjnej stosowanej według zmodyfikowanego schematu MVAC na przeżycie chorych leczonych z powodu naciekającego raka pęcherza moczowego z uwzględnieniem stopnia złośliwości nowotworu (G). Urol Pol, 2002. 55(1).
- Lawrentschuk, N., et al., Prevention and Management of Complications Following Radical Cystectomy for Bladder Cancer. Eur Urol.
- Stein, J.P. and D.G. Skinner, Radical cystectomy for invasive bladder cancer: long-term results of a standard procedure. World J Urol, 2006. 24(3): p. 296-304.
- Stein, J.P. and D.G. Skinner, Results with radical cystectomy for treating bladder cancer: a 'reference standard' for high-grade, invasive bladder cancer. BJU Int, 2003. 92(1): p. 12-7.
- Cookson, M.S., et al., Complications of radical cystectomy for nonmuscle invasive disease: comparison with muscle invasive disease. J Urol, 2003. 169(1): p. 101-4.
- Eastham, J.A., Do high-volume hospitals and surgeons provide better care in urologic oncology? Urol Oncol, 2009. 27(4): p. 417-21.
- Tollefson, M.K., et al., Significance of distal ureteral margin at radical cystectomy for urothelial carcinoma. J Urol. 183(1): p. 81-6.
- Madersbacher, S., et al., Radical cystectomy for bladder cancer today--a homogeneous series without neoadjuvant therapy. J Clin Oncol, 2003. 21(4): p. 690-6.
- Hautmann, R.E., et al., Long-term results of standard procedures in urology: the ileal neobladder. World J Urol, 2006. 24(3): p. 305-14.
- Herr, H.W., Timing of cystectomy for superficial bladder tumors. Urol Oncol, 2000. 5(4): p. 162-165.
- Herr, H.W. and P.C. Sogani, Does early cystectomy improve the survival of patients with high risk superficial bladder tumors? J Urol, 2001. 166(4): p. 1296-9.
- Hautmann, R.E. and T. Paiss, Does the option of the ileal neobladder stimulate patient and physician decision toward earlier cystectomy? J Urol, 1998. 159(6): p. 1845-50.
- Sanchez-Ortiz, R.F., et al., An interval longer than 12 weeks between the diagnosis of muscle invasion and cystectomy is associated with worse outcome in bladder carcinoma. J Urol, 2003. 169(1): p. 110-5; discussion 115.
- Heidenreich, A., C.H. Ohlmann, and S. Polyakov, Anatomical extent of pelvic lymphadenectomy in patients undergoing radical prostatectomy. Eur Urol, 2007. 52(1): p. 29-37.
- Schoenberg, M.P., H.B. Carter, and J.I. Epstein, Ureteral frozen section analysis during cystectomy: a reassessment. J Urol, 1996. 155(4): p. 1218-20.
- Freeman, J.A., et al., Urethral recurrence in patients with orthotopic ileal neobladders. J Urol, 1996. 156(5): p. 1615-9.
- Weizer, A.Z., et al., Evaluation of the prostate peripheral zone/capsule in patients undergoing radical cystoprostatectomy: defining risk with prostate capsule sparing cystectomy. Urol Oncol, 2007. 25(6): p. 460-4.
- Joung, J.Y., et al., Incidental prostate cancer detected by cystoprostatectomy in Korean men. Urology, 2009. 73(1): p. 153-7.
- Chun, T.Y., Coincidence of bladder and prostate cancer. J Urol, 1997. 157(1): p. 65-7.
- Kefer, J.C. and S.C. Campbell, Current status of prostate-sparing cystectomy. Urol Oncol, 2008. 26(5): p. 486-93.
- Zebic, N., S. Weinknecht, and D. Kroepfl, Radical cystectomy in patients aged > or = 75 years: an updated review of patients treated with curative and palliative intent. BJU Int, 2005. 95(9): p. 1211-4.
- El-Tabey, N.A., et al., Bladder cancer with obstructive uremia: oncologic outcome after definitive surgical management. Urology, 2005. 66(3): p. 531-5.
- Nagele, U., et al., The rationale for radical cystectomy as primary therapy for T4 bladder cancer. World J Urol, 2007. 25(4): p. 401-5.
- Di Saia, P. and P. Morrow, Pelvic exenteration. Calif Med, 1973. 118: p. 13-17.
- Lopez, M.J., J.G. Petros, and P. Augustinos, Development and evolution of pelvic exenteration: historical notes. Semin Surg Oncol, 1999. 17(3): p. 147-51.
- Hockel, M. and N. Dornhofer, Pelvic exenteration for gynaecological tumours: achievements and unanswered questions. Lancet Oncol, 2006. 7(10): p. 837-47.
- Crowe, P.J., et al., Pelvic exenteration for advanced pelvic malignancy. Semin Surg Oncol, 1999. 17(3): p. 152-60.
- Petros, J.G., P. Augustinos, and M.J. Lopez, Pelvic exenteration for carcinoma of the colon and rectum. Semin Surg Oncol, 1999. 17(3): p. 206-12.
|
