| ||||||||
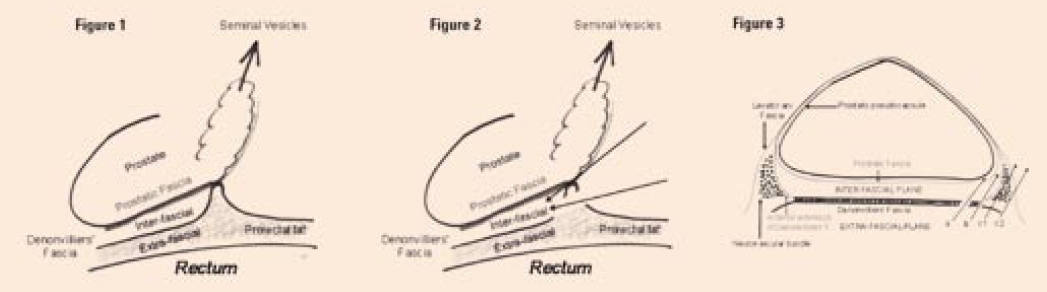
Sprawozdanie z Europejskiego Kongresu Laparoskopii - część IIRzym, 2010 r.Po bardzo ciekawym wykładzie Inderbira Gilla o TRIFECTA w operacjach nerkooszczędzających z kolejną prezentacją wystąpił Frans Debruyne. Na wstępie zauważył, że rutynowe oznaczanie poziomu PSA niewątpliwie zwiększyło rozpoznawalność raka stercza, ale marker ten, chociaż specyficzny dla stercza, nie jest specyficzny dla raka tego narządu. Skutkuje to wykonywaniem wielu niekoniecznych biopsji stercza przy podwyższonym poziomie tego enzymu. Stąd poszukiwanie lepszego, bardziej swoistego markera, wskazującego tych pacjentów, u których biopsja stercza byłaby niezbędna. Takim biomarkerem mógłby być antygen raka stercza 3 (Prostate Cancer Antigen 3 - PCA3), którego poziom wzrasta w nowotworze gruczołu krokowego. Obecnie dostępne już są dokładne i szybkie testy oznaczające poziom tego biomarkera w moczu i wykorzystanie ich w praktyce klinicznej jest prawdopodobnie tylko kwestią czasu. Marek Roslan, Piotr Cieśliński Kongresy, sympozja Według autora prezentacji jest to najlepszy znacznik wskazujący na konieczność powtórzenia biopsji stercza po pierwszej negatywnej. Wysoki poziom PCA3 koreluje z 60% wykrywalnością raka w kolejnej biopsji. Następnie Luis Martinez-Piňeiro przedstawił anatomię powięzi gruczołu krokowego. Temat wydawałoby się dobrze znany, jednak postęp laparoskopii rzucił nowe światło na układ tych warstw i praktyczne wykorzystanie tej wiedzy. Według Martineza-Piňeira powięź Denonvilliersa jest pojedynczą warstwą łącznotkankową oddzielającą stercz od odbytnicy. Uważa on, że praktycznie nie można odróżnić przedniej i tylnej blaszki tej powięzi, tak jak to opisują podręczniki anatomii. Zatem gruczoł krokowy bezpośrednio otacza pseudotorebka (prostatic pseudocapsule), do niej przylega powięź stercza, a tę od odbytnicy oddziela powięź Denonvilliersa. W okolicy podstawy stercza część powięzi Denonvilliersa kieruje się ku przodowi, oddzielając w tym miejscu stercz od pęczków naczyniowo-nerwowowych (ryc. 1).
Chirurdzy laparoskopowi w większości są zgodni, że radykalne usunięcie stercza można wykonać w trzech płaszczyznach (warstwach): 1) śródpowięziowo (intrafascial), czyli preparując pomiędzy pseudotorebką a powięzią stercza, 2) międzypowięziowo (interfascial), czyli między powięzią stercza a powięzią Denonvilliersa i 3) zewnątrzpowięziowo (extrafascial), czyli między powięzią Denonvilliersa a odbytnicą. Według autora tylko operowanie w dwóch pierwszych warstwach - intra- lub interfascial - pozwala zachować pęczki naczyniowo-nerwowe. Operowanie w warstwie najbliżej stercza jest bardziej ryzykowne, bo łatwiej o pozytywny margines. Płaszczyzna międzypowięziowa jest praktycznie nieunaczyniona i najłatwiej na nią natrafić preparując od szyi pęcherza i przecinając przyczep powięzi Denonvilliersa do podstawy stercza. Na zakończenie wykładu Luis Martinez-Piňeiro zaprezentował film sprzed 100 lat pokazujący operację wycięcia nerki w czasie 10 minut. Ruchy operatorów były tak błyskawiczne, że trudno było je śledzić. Richard Gaston podziękował Hiszpanowi za wyczerpujące przedstawienie anatomii gruczołu krokowego. Potwierdził wagę właściwego przecięcia powięzi Denonvilliersa przy pęcherzykach nasiennych. Dodał, że powięź ta jest różna u różnych chorych, ale zawsze jest pojedyncza. Jeśli ma się 2 warstwy powięzi dystalnie od stercza, to znaczy, że się jest śródpowięziowo (intrafascial). Podkreślił, że powięź właściwa stercza (prostatic fascia) może się składać z kilku warstw. Chociaż laparoskopowo wejście w warstwę interfascial uzyskuje się najczęściej od strony pęcherzyków nasiennych, to w przypadku operacji z użyciem robota etap ten może być łatwiejszy od strony wierzchołka (retrograde). Głos w dyskusji zabrał też Günter Janetschek, który zwrócił uwagę, że w okolicy wierzchołka stercza omawiane powięzie nie występują. Jensowi Rassweilerowi przypadł w udziale temat ergonomii w chirurgii laparoskopowej i z asystą robota. Rozpoczął od stwierdzenia faktu, że obecnie w Stanach Zjednoczonych ok. 70% wszystkich prostatektomii radykalnych wykonuje się laparoskopowo z asystą robota (RALP). Przewaga tej metody wynika głównie z aspektów ergonomicznych, tzn. wygodnej pozycji chirurga, wielofunkcyjności manipulatorów i trójwymiarowego obrazu. Klasyczna laparoskopia wymaga od chirurga znacznie większego wysiłku umysłowego i fizycznego, stałej kontroli wskaźników i instrumentów, dobrej koordynacji pracy rąk i nóg, a także niefizjologicznego ułożenia ciała. Stąd poszukiwania nowych rozwiązań, takich jak specjalne stoły operacyjne, mobilne monitory, zintegrowane przyciski nożne itp. Konkluduje, że obecnie o sukcesie operacji decyduje wybór najlepszego chirurga, ale w przyszłości decydująca będzie ergonomia. Niejako kontynuacją wykładu Rassweilera była prezentacja G. Janetscheka "Robotics beyond da Vinci". Przewiduje on dalszy rozwój technik z użyciem robotów, opracowanie nowych jednostek konkurencyjnych w stosunku do da Vinci, dalsze usprawnienie systemów wizyjnych i manipulatorów, powstanie nowych procedur, pośrednich między konwencjonalną laparoskopią a robotics. Podsumowując G. Janetschek stwierdził, że roboty już weszły do urologii i żaden krok wstecz jest ani możliwy, ani korzystny. Ostatni wykład tego dnia miała Cora Sternberg, stała wykładowczyni tych kongresów, a prywatnie żona Vito Pansadoro. Tytuł prezentacji: "Nowe terapie w raku nerki". Omówiła kolejno 6 nowych leków, które zostały zatwierdzone do leczenia zaawansowanego raka nerkowokomórkowego w ostatnich latach. Leki te mają hamować angiogenezę. Takie działanie wykazały inhibitory kinazy tyrozynowej - sunitinib, bevacizumab, pazopanib i sorafenib oraz inhibitory mTOR (mammalian target of rapamycin) - temsirolimus i everolimus. W randomizowanych badaniach w przerzutowym raku nerki leki te zwiększały blisko dwukrotnie czas przeżycia bez progresji choroby (średnio do ok. jednego roku). Całkowite przeżycie też było o kilka miesięcy dłuższe, ale różnica nie była znamienna statystycznie. Co ciekawe, kwalifikowani do programów pacjenci nie zawsze mieli wcześniej wykonaną nefrektomię. Nie wszyscy też reagowali na leczenie. Na przykład częstość odpowiedzi (response rate - RR) dla sunitinibu wynosiła 39%, dla pazopanibu 30%, a dla sorafenibu 10%. Pojawiły się nieliczne doniesienia, że chemioterapia przedoperacyj na może zmniejszyć masę guza. I tak w badaniu Van der Weldta, na grupie 22 chorych, po zastosowaniu sunitinibu u ponad połowy pacjentów objętość guza zmniejszyła się od 18% do 60%. Rola cytoredukcyjnej nefrektomii w erze celowanej terapii wymaga zatem dalszych badań. W podsumowaniu C. Sternberg stwierdziła, że w raku nerki z przerzutami mamy obecnie trzy terapie "first line": 1) sunitinib, 2) bevacizumab + interferon i 3) pazopanib. Drugi dzień rozpoczął się sesją operacyjną. Moderatorem prawie całej sesji był Urs Studer. To niezwykłe, jak chirurg, który nie wykonuje laparoskopii, potrafi wspaniale komentować przeprowadzane operacje i taktownie zasugerować operatorom krok, który rzeczywiście ułatwiał zabieg. Pierwszy operował laparoskopowo Renaud Bollens. Cztery trokary, instrumenty standard - w lewej ręce kleszczyki bipolarne, w prawej - nożyczki mono. Wyciął lewy jajnik i część lewego moczowodu zwężonego z powodu endometriozy. Moczowód przeszczepił modyfikowanym sposobem Lich-Gregoire'a. Umocowanie do mięśnia biodrowo-lędźwiowego dwoma szwami Vicryl 2/0. Typowe kłopoty przy wprowadzeniu cewnika podwójnie zagiętego. Czas operacji - dwie i pół godziny. Niemal w tym samym czasie lekko przeziębiony i pokasłujący Inderbir Gill z asystą robota wyciął pęcherz moczowy u kobiety z powodu raka T2G3. Końce moczowodów posłał do badania doraźnego. Pozostawił macicę, a preparowanie pęcherza ułatwiało wprowadzenie do pochwy prawidła owiniętego gąbką. Delikatnie odpreparował cewkę moczową, oszczędzając jej więzadła (wg Ulmstena istnieją!). Czas tego etapu - trzy i pół godziny.
Następnie operację kontynuował Peter Wiklund. Sprawnie wyciął rozlegle węzły chłonne biodrowe i zasłonowe. Studer podkreślał potrzebę usuwania węzłów okolicy rozwidlenia aorty oraz odejścia tętnicy podbrzusznej. Te ostatnie często nie są uwidocznione w badaniu TK, a mogą w nich znajdować się ogniska mikroprzerzutów. Zadawał wnikliwe, ale istotne pytania, komentując na bieżąco następujące po sobie etapy operacji. Obaj się zgadzali, że nie trzeba robić badania doraźnego węzłów, bo nie zmienia to postępowania, nawet gdy węzły są makroskopowo przerzutowe. Do zespolenia jelitowego P. Wiklund użył staplerów. W tym miejscu prof. Studer zalecał uważne zakładanie staplera, tak aby w linii zszywek nie znalazła się krezka jelita. Wyizolowaną pętlę krętnicy najpierw zespolił z cewką moczową, a dopiero potem rozciął jelito i wprowadził cewnik Foleya. Jeden koniec pętli pozostał zamknięty linią zszywek. Pęcherz zastępczy Studer formował już szwem ciągłym, zakładanym pomiędzy dwoma pojedynczymi szwami, które chwycone grasparami stabilizowały pętlę jelitową, ułatwiając szycie. Do jednego z grasparów wykorzystał czwarte ramię robota. Szycie ułatwiło użycie instrumentu Lapratie (Ethicon, Cincinnati, OH, USA). Etap ten wzbudził uznanie oglądających - oceniono go jako bardzo dobry trik. Moczowody zaszynował cewnikami pojedynczo zagiętymi, które wyprowadził przez pęcherz zastępczy i następnie przez powłoki. W dyskusji - przywołując pracę Wikinga Månssona z Lund, który porównał różne rodzaje zbiorników jelitowych - zgodnie stwierdzono, że najlepszy jest ortotopowy pęcherz zastępczy wytwarzany z jelita cienkiego. Przyznano też, że w operacjach z użyciem robota jest stosunkowo dużo zwężeń w miejscu zespolenia moczowodowo-jelitowego. Liczba tych operacji jednak stale rośnie i np. w Karolinska Institute obecnie 25% cystektomii to operacje robotics, niemniej jednak nadal nie jest to duża liczba, gdyż w okresie 2003-2009 wykonano tych operacji 41. Znacząca jest nadal liczba wczesnych i odległych powikłań, wynosząca odpowiednio 34% i 27%. W tym samym czasie Renaud Bollens wykonał laparoskopowe usunięcie węzłów chłonnych zaotrzewnowych u chorego po chemioterapii z powodu raka jądra. Stosował odmienną technikę niż w trak-cie wcześniejszych kongresów prezentowali Günter Janetschek i Ingolf Türk. Pacjent ułożony mocno na lewym boku, układ trokarów typowy, narzędzia podobnie jak inni operatorzy, czyli w lewej ręce kleszczyki bipolarne, w prawej najczęściej nożyczki monopolarne. Po zsunięciu wstępnicy i korzenia krezki odsłonił żyłę główną dolną i aortę wraz z masą węzłową. Preparowanie zaczął od rozwidlenia aorty. Delikatne, w 90% "na ostro", odsłonięcie żyły głównej zrobiło spore wrażenie. Komentujący U. Studer zgodził się, że usunięcie w tym przypadku żyły jądrowej prawej jest niezbędne. Komplementowany Bollens odpowiedział, że robi tylko to, co w danym momencie jest możliwe. Oprócz pakietu węzłów usunął również żyłę nasienną, tkanki zza żyły głównej oraz spomiędzy dużych naczyń. Kolejną sesję wykładową rozpoczął Urs Studer dwiema prezentacjami: "Zasadnicze cele i zakres limfadenektomii w raku stercza i raku pęcherza" oraz "Cystektomia z zaoszczędzeniem pęczków naczyniowo-nerwowych". Zawsze przy cystektomii zaleca usuwać węzły chłonne miedniczne. Nawet 30% chorych N+ będzie żyło bez progresji choroby, u wielu będzie można uniknąć chemioterapii. Im więcej usuniętych węzłów, tym lepiej. Zwrócił uwagę, że 8% węzłów znajduje się przy rozwidleniu aorty i tkanki tego obszaru powinny być usunięte wraz z nerwami podbrzusznymi. Nawet jeśli w badanym materiale nie stwierdzi się przerzutów, to i tak pacjent może odnieść korzyść z takiego postępowania. Zbliżone zdanie miał w innej prezentacji Inderbir Gill, chociaż przytoczył dane, że w USA 40% cystektomii odbywa się bez wycięcia węzłów chłonnych. Kontynuując prezentację Studer, podobnie jak przy cystektomii, podkreślił wartość limfadenektomii w raku gruczołu krokowego. Pacjenci z usuniętymi węzłami najczęściej przeżyją 10 lat bez progresji i niejako są uwolnieni od "terroryzmu PSA". Gdy, opierając się na przedoperacyjnym PSA i skali Gleasona, nie wykonamy limfadenektomii, to u jednej trzeciej operowanych stopień złośliwości histologicznej okaże się wyższy i brak wycięcia węzłów wywoła poczucie niedostatecznego leczenia. Powołując się na publikację Skinnera uważa, że chory odniesie korzyść nawet wówczas, jeśli węzły okażą się N0, gdyż mogą się w nich znajdować ogniska mikroprzerzutów, niewykrytych w standardowym badaniu histopatologicznym. Omawiając drugi temat Studer wnioskował, że wycinając pęcherz moczowy u mężczyzny, warto zaoszczędzić pęczek naczyniowo-nerwowy przynajmniej po jednej stronie. Pozwala to zachować unerwienie autonomiczne i dłuższy odcinek czynnościowy cewki, co w rezultacie przynosi lepsze wyniki w zakresie trzymania moczu. Chcąc zwiększyć szanse na zachowanie trzymania moczu i potencji, zaleca u starannie wyselekcjonowanych chorych rozważyć pozostawienie obu pęcherzyków nasiennych i pęczków naczyniowo-nerwowych w sytuacji, gdy PSA jest mniejsze niż 10 ng/ml. Argumentował, że - w takiej sytuacji - przy cystektomii 90% wycięć stercza jest niepotrzebnych. Kończąc przypomniał, że nie jest ważne, jaką techniką operuje się chorego, najważniejsze jest, żeby dobrze znać anatomię operowanej okolicy. Następnie Franco Gaboardi miał wykład o radykalnym wycięciu stercza z dostępu przy jeden port (LESS). Przewrotnie dodał pytanie: mit czy rzeczywistość? Wykonuje te operacje (10 do stycznia 2010, bez konwersji, czas operacji śr. 230 min) przezotrzewnowo, używając prostego imadła i odpowiednich, wygiętych narzędzi: kamera 5-milimetrowa z ruchomym końcem, narzędzia również 5-milimetrowe, ssak jest dłuższy od standardowego. Zawsze dodaje jeszcze jeden port laparoskopowy, ale nie wątpi, że to nadal jest LESS. Bernardo Rocco przedstawił pracę dowodzącą, że wykonanie tzw. rekonstrukcji tylnej (Rocco stitch) poprawia statystycznie znamiennie powrót trzymania moczu we wczesnym (1 i 3 miesiące) okresie po radykalnym wycięciu stercza. Vipul Patel podsumował wyniki 1100 wykonanych przez siebie radykalnych prostatektomii z asystą robota (robot-assisted radical prostatectomy - RARP). Po 18 miesiącach trzymało mocz (no pads) 97,9% operowanych, potencję zachowało 96,6%, bez wznowy biochemicznej pozostawało 91,6% leczonych. Ogółem trifecta (czyli kontynencja, potencja i brak wznowy biochemicznej) po 1,5 roku osiągnęło 91% jego pacjentów. Trzeba przyznać, że to wynik imponujący. Cały ostatni dzień kongresu zajęła sesja operacyjna - tylko prostatektomie radykalne. Wszyscy pacjenci byli przed operacją przedstawieni standardowo, ale dla każdego chorego podano też wyniki z nomogramu MSKCC (Memorial Sloan-Kettering Cancer Center nomogram, Kattan nomogram). Specjalnie dla potrzeb tej sesji Richard Gaston wykonał laparoskopową przezotrzewnową prostatektomię. Specjalnie, gdyż - jak sam powiedział - od około roku wycina stercz wyłącznie robotics. Oglądanie operującego Gastona za każdym razem nieodparcie przywołuje myśl, że medycyna nadal jest sztuką, i że jest jeszcze w niej miejsce dla najwyższego lotu artystów. Oprócz możliwości podziwiania nienagannej techniki, urolodzy mogli wysłuchać cennych komentarzy, wypowiadanych przez jednego z najbardziej doświadczonych i najbieglejszych chirurgów laparoskopowych. Z kronikarskiego obowiązku podamy parę szczegółów samej operacji. Cztery trokary 5-milimetrowe dla manipulatorów i jeden 12-milimetrowy dla kamery. Ciepła sól do przetarcia kamery w zwykłym termosie. Kierunek preparowania "antegrade". Do zaopatrzenia naczyń - 2- i 5-milimetrowe klipsy. Precyzyjne odpreparowanie pęczka naczyniowo-nerwowego w okolicy podstawy stercza. Pęcherzyki nasienne odcinane w połowie, aby uniknąć uszkodzenia delikatnej siatki unerwienia autonomicznego. Zsuwanie "na tępo" powięzi miednicznej (bez jej otwierania) i więzadeł łonowo-sterczowych, aby dojść do wierzchołka stercza. Żyła grzbietowa prącia przecinana dopiero po odsłonięciu tylnego aspektu gruczołu krokowego. Zespolenie pęcherzowo-cewkowe szwem ciągłym Vicryl 2/0 lub 3/0, bez wprowadzonego cewnika. Prawa ręka - imadło, lewa - prosty graspar. Prowadzenie szwu: pęcherz - outside-in, cewka - odwrotnie. Sprawdzenie szczelności zespolenia. Komentarze R. Gastona do operacji i odpowiedzi na pytania z podium oraz z sali:
W tym samym czasie na innej sali z asystą robota da Vinci operował Mani Menon z Vattikuti Urology Institute z Detroit. Wykorzystywał 3 ramiona robota, gdyż dodatkowe ramię znacznie podwyższa koszty operacji. Preparował manipulatorem monopolarnym zakończonym haczykiem. Nie używał klipsów. Do podwiązania żyły grzbietowej prącia użył szwu V-loc 3/0. Jest to nić z mexonu, mająca na przebiegu drobne "haczyki" zapobiegające cofaniu się nitki w tkance, o czasie wchłaniania wynoszącym ok. 6 miesięcy. Takiej nici użył również do zespolenia pęcherzowo-cewkowego. Zastosował interesującą taktykę - najpierw wykonał rekonstrukcję tylną (Rocco stitch), a dopiero potem zespolił pęcherz z cewką moczową. Sposób zakładania szwu jak u Rolanda Van Velthovena. W Vattikuti Urology Institute od 2006 roku wykonano 4500 prostatektomii radykalnych, stale doskonaląc technikę. Tam właśnie opracowano sposób niejako wyłuskania wierzchołka stercza i początkowego odcinka cewki z otaczających tkanek, aby zachować jak najwięcej unerwienia tej okolicy. Takie oddzielenie tych tkanek nazwano Super Veil Nerve Sparing (Welon Afrodyty). Jest to czasochłonny etap operacji, ale przynosi efekty. Niemniej potencję osiąga 18-36% operowanych, a 72% jest niezadowolonych ze wzwodu. W kolejnej operacji robotics (wg planu - prostatektomia robotics zaotrzewnowa) Xu Hang ok. 45 min poświęcił na podłączenie ramion robota, miał też kłopoty z utrzymaniem odmy i dokończył operację przezotrzewnowo. Trochę długi wyszedł ten tekst, ale tyle informacji wydawało się wartych przekazania, że chyba nie mógł być krótszy. Na zakończenie impresja, która się nasunęła pod koniec obrad - że można na dużym kongresie mówić 3 dni o raku stercza i nawet nie wspomnieć o hormonoterapii, tak powszechnej w codziennej praktyce polskich urologów. Ocena kongresu: sześć gwiazdek (w skali pięciogwiazdkowej). dr n. med. Marek Roslan |
||||||||