| ||||||||
Limfadenektomia miednicza towarzysząca usunięciu pęcherza w leczeniu chorych na naciekającego raka pęcherza moczowegoOcena spływu chłonki z narządów układu moczowo-płciowego ma istotne znaczenie w procesie diagnostycznym i leczniczym. Jest on przedmiotem zainteresowania wielu dyscyplin medycznych, nie tylko tych zajmujących się chirurgicznym leczeniem chorób nowotworowych miednicy mniejszej. W polskim piśmiennictwie istnieje niewiele prac poświęconych tej tematyce. Przeglądając literaturę dotyczącą tego tematu można stwierdzić, że coraz większe znaczenie, poza usunięciem „chorego narządu”, ma wykonanie prawidłowej i bardziej rozległej limfadenektomii. Węzły chłonne a nowotwory Komórki rozwijające się w guzie pierwotnym tracą zdolności adhezyjne. W następstwie tego dochodzi do rozluźnienia macierzy poza-komórkowej. Zmniejszają się też oddziaływania międzykomórkowe. Część komórek nowotworowych, na skutek degradacji błony komórkowej, dostaje się do naczyń krwionośnych i chłonnych, drogą których przenoszone są po całym organizmie. Mogą osiedlać się w nowym miejscu, co może prowadzić do powstania przerzutu, jednak tylko nieliczne komórki nowotworowe są w stanie przeżyć i osiedlić się w nowej lokalizacji (~1/1 mln). Powszechnie wiadomo, że powiększone węzły chłonne mogą być albo wynikiem odpowiedzi immunologicznej na obce antygeny, albo proliferacji komórek nowotworowych. Limfa spływająca do węzła chłonnego z narządu objętego nowotworem jest filtrowana, a zatrzymane w nim komórki nowotworowe są niszczone przez naturalne komórki cytotoksyczne, aktywowane makrofagi, limfocyty T cytotoksyczne i swoiste przeciwciała. Węzeł chłonny jest więc naturalną barierą dla rozprzestrzeniania się nowotworu. Często jednak nieskuteczną, dlatego dochodzi do przerzutów. Ważne jest więc, aby razem z usunięciem ogniska pierwotnego w trakcie radykalnego zabiegu chirurgicznego usuwać także regionalne węzły chłonne. Wobec powyższego logiczne jest stwierdzenie, że wszystkie usunięte węzły chłonne powinny być policzone, zmierzone oraz należy określić okolicę anatomiczną, skąd zostały pobrane. W wypadku gdy stwierdzono w nich przerzuty nowotworowe, należy dodatkowo podać wymiar węzła i liczbę zajętych węzłów w stosunku do wszystkich usuniętych. Węzły chłonne przestrzeni zaotrzewnowej są stacją przerzutową no-wotworów różnych narządów miednicy mniejszej, w tym raka pęcherza moczowego. Omawiając kierunki spływu chłonki z narządów miednicy, trudno jest mówić o regionalnych węzłach chłonnych, ponieważ każdy organ połączony jest swoimi naczyniami chłonnymi z wieloma grupami węzłów chłonnych, a te z kolei bogato zespalają się między sobą. Anatomia spływu chłonki z pęcherza moczowego Spływ chłonki z pęcherza moczowego odbywa się przez zbiór naczyń chłonnych i węzłów chłonnych połączonych w kilka grup. Naczynia chłonne tworzą w ścianie pęcherza moczowego sploty wewnątrzi zewnątrzmięśniowe. Ze splotów tych chłonka odpływa do trzech grup drobnych węzłów chłonnych, zwanych węzłami chłonnymi przypęcherzowymi, położonych w tkance tłuszczowej okołopęcherzowej - grupy: prawa, lewa oraz przednia. Z tylnej ściany pęcherza chłonka spływa do węzłów chłonnych biodrowych zewnętrznych. Spływ ze ściany przedniej oraz bocznych odbywa się ponadto do węzłów chłonnych biodrowych wewnętrznych. Z dna pęcherza i trójkąta do węzłów chłonnych biodrowych wewnętrznych i biodrowych wspólnych. Te ostatnie uważane są za drugą stację przerzutów drogą chłonną między węzłami chłonnymi biodrowymi a węzłami lędźwiowymi pośrednimi. Bezpośredni odpływ chłonki do węzłów chłonnych biodrowych wspólnych jest niestały. Epidemiologia raka pęcherza moczowego Rak pęcherza moczowego jest nowotworem złośliwym rozwijającym się z nabłonka przejściowego dróg moczowych. Pod względem częstości występowania wśród nowotworów dróg moczowo-płciowych plasuje się na drugim miejscu. W populacji męskiej zajmuje piąte miejsce pod względem częstości występowania w Europie oraz czwarte w Stanach Zjednoczonych. U amerykańskich kobiet plasuje się na dziesiątym miejscu wśród rozpoznanych nowotworów złośliwych. W USA rocznie rozpoznaje się 68 000 nowych przypadków raka pęcherza moczowego. Ryzyko zachorowania
u białych mężczyzn wynosi 3%, a u białych kobiet 1%. Rak pęcherza moczowego występuje w każdym wieku. Szczyt zachorowań przypada na okres między 50-80 rokiem życia (80% rozpoznań) i występuje 4 razy częściej w populacji męskiej. W ostatnim dwudziestoleciu zaobserwowano wzrost liczby zachorowań o około 50%. Raport pochodzący z danych Centrum Onkologii pokazuje, iż
w 1999 roku w Polsce w populacji męskiej rozpoznano 3751 nowych przypadków nowotworów złośliwych pęcherza moczowego. W roku 2005 liczba rozpoznań wzrosła do 4125. Współczynnik zapadalności (incidence) wśród mężczyzn w ciągu 6 lat wzrósł o ponad 11%. W 1999 roku nowotwory złośliwe pęcherza moczowego u mężczyzn były sklasyfikowanena4.miejscupodwzględemliczbyrozpoznań - po nowotworach płuc i oskrzeli, gruczołu krokowego
i żołądka. W 2005 roku przesunęły się na 3. pozycję i ustępowały w częstości tylko nowotworom płuc i oskrzeli oraz gruczołu krokowego. Liczba nowo rozpoznanych przypadków nowotworów złośliwych pęcherza moczowego wśród kobiet w roku 1999 wyniosła 873. W roku 2005 liczba ta wzrosła o 228 przypadków, dając 1101 nowych rozpoznań. Współczynnik zapadalności wzrósł między rokiem 1999 a 2005 o 28%. Pod względem częstości rozpoznań nowotwory złośliwe pęcherza moczowego u kobiet zajmowały 17. miejsce
w 1999 roku. W roku 2005 przesunęły się na 16. miejsce. Pod względem umieralności (płeć męska) wśród wszystkich zgonów z powodów złośliwych procesów rozrostowych nowotwór ten zajmuje 6. miejsce. W populacji kobiet 15. miejsce wśród zgonów z przyczyn nowotworowych. Wyniki leczenia operacyjnego - zakres limfadenektomii miedniczej Cystektomia radykalna połączona z obustronną limfadenektomią miedniczo-biodrową (pelvic iliac lymph node dissection - PILND) jest standardową metodą leczenia naciekającego raka pęcherza moczowego. Osiągane współcześnie wyniki cystektomii radykalnej i usunięcia węzłów chłonnych miedniczych w stadium zaawansowania T2-4NxM0 raka przejściowonabłonkowego pęcherza moczowego wskazują, że operacja ta jest obarczona niską śmiertelnością (0,5-3%). U większości chorych z miejscowo zaawansowanym rakiem pęcherza moczowego zapewnia ona kontrolę i przeżycie, zależne jednak od cech T i N. Umożliwia też dokładną ocenę stopnia zaawansowania patologicznego nowotworu i węzłów chłonnych. Nawet w chorobie zaawansowanej miejscowo - określanej jako naciekanie guza poza ścianę pęcherza moczowego do otaczającej go tkanki tłuszczowej (pT3) bądź okolicznych narządów (pT4) i/lub rozsiew do naj-bliższych węzłów chłonnych - właściwie wykonana cystektomia z rozszerzoną limfadenektomią miedniczo-biodrową może u wielu chorych przyczynić się do przedłużenia czasu przeżycia wolnego od nowotworu oraz doskonałej kontroli w obrębie miednicy. Dzięki rosnącemu i coraz powszechniejszemu doświadczeniu w wy-twarzaniu odprowadzeń trzymających mocz i chirurgii oszczędzającej pęczki nerwowe może zostać zachowana wysoka jakość życia, mimo okaleczającej natury zabiegu. Operacja prowadzi do wyleczenia (5-letnie przeżycie) u 60-80% chorych, u których nowotwór nacieka błonę mięśniową, ale jest ograniczony do narządu (pT2). Dla chorych bez zajęcia węzłów chłonnych wskaźnik 5-letniego przeżycia wynosi 64-86%, natomiast dla tych z rakiem zaawansowanym miejscowo (pT3-T4) - 22-58%. Zabieg ten leczy 20-30% chorych z potwierdzoną obecnością przerzutów w węzłach chłonnych. Wskaźnik 5-letniego przeżycia wynosi 50% dla chorych z przerzutami w węzłach chłonnych i nowotworem ograniczonym do błony mięśniowej, podczas gdy dla tych z bardziej zaawansowanym guzem pierwotnym obniża się znacząco - do 18% i mniej. Ghoneim i wsp. stwierdzili ponadto, iż przeżycie chorych z N1 jest porównywalne z przeżyciem chorych z N0. Dane te świadczą o ograniczeniach cystektomii radykalnej i zmuszają do doskonalenia techniki operacji polegającej głównie na rozszerzaniu zakresu wykonywanej podczas niej limfadenektomii. Jak wiadomo, celem tego zabiegu jest usunięcie całej tkanki nowotworowej w obrębie pęcherza moczowego, miednicy i okolicznych węzłów chłonnych. Kolejnym celem jest wyodrębnienie chorych, u których istnieje prawdopodobieństwo nawrotu raka. Wiemy, że po cystektomii radykalnej bardziej prawdopodobne jest pojawienie się przerzutów odległych niż wznowa miejscowa. Niepowodzenie leczenia operacyjnego wynika niezmiennie z obecności ukrytych przerzutów już w czasie wykonywania cystektomii. Wprawdzie zarówno wyleczenie, jak i dokładna ocena stadium zaawansowania patologicznego zależą od jakości przeprowadzenia zabiegu usunięcia pęcherza moczowego, nie ma jednak powszechnie przyjętych standardów dotyczących jego wykonania oraz rozległości wycięcia węzłów chłonnych. Zalecenia EAU z 2009 roku mówią, że usunięcie węzłów chłonnych w czasie cystektomii jest integralną częścią tego zabiegu, jednak dokładnie nie określają jego zakresu. Co do zakresu operacji to największe znaczenie ma oczywiście obecność ujemnych marginesów chirurgicznych. Większość nawrotów miejscowych występuje wprawdzie u osób ze znacznym naciekaniem nowotworu poza pęcherz (pT3-T4) lub z zajętymi węzłami chłonnymi, jednak u wielu nie dochodzi do wznowy. Wskazuje to, że chirurg powinien dokonać resekcji tak szeroko wokół pęcherza, jak to tylko możliwe, niezależnie od zaawansowania raka w obrębie miednicy, podejmując ten wysiłek w celu uzyskania ujemnego marginesu chirurgicznego. Jeśli chodzi o zakres limfadenektomii, wykazano, że zarówno liczba usuniętych węzłów chłonnych, jak i sposób, w jaki materiał przekazano do oceny histopatologicznej, mają wpływ na wyniki cystektomii. Gdy poszczególne grupy węzłów chłonnych dostarcza się patologowi w odrębnych pojemnikach, wyodrębnia i ocenia on więcej z nich. Zakres usuwania węzłów chłonnych Nie określono wprawdzie jasno niezbędnego zakresu usunięcia węzłów chłonnych, ale Lerner, Herr, Bochner wskazują niezależnie, że uzyskiwanie dużej liczby węzłów chłonnych wiąże się z lepszą kontrolą miejscową i dłuższym przeżyciem w związku z bardziej rozległą PILND, jak też z dokładniejszym usunięciem i identyfikacjąwęzłów chłonnych z mikroprzerzutami. Chorzy z przerzutami do węzłów chłonnych wykazują duże ryzyko nawrotu i progresji nowotworu w porównaniu z chorymi bez zmian w węzłach chłon-nych (guz ograniczony do narządu lub wychodzący poza pęcherz). Jednak, jak już wspomniano wcześniej, Herr, Poulsen, Leissner i wsp. stwierdzili w różnych badaniach, że zakres i/lub doszczętność limfadenektomii mogą poprawiać przeżycie chorych na raka pę-cherza. Stein, Vieweg, Skinner, Herr i wsp. piszą, że dzięki właściwie wykonanej cystektomii radykalnej połączonej z PILND prawie co trzeci pacjent osiąga przeżycie odległe. PILND przynosi zarówno korzyść terapeutyczną, jak i dostarcza informacji rokowniczych. Mimo tych danych brak jest zgodności co do granic usunięcia tkanki chłonnej oraz minimalnej liczby węzłów, które należy usunąć. Proponowane granice resekcji węzłów chłonnych przedstawiono na rycinie 1. Istnieje kilka ważnych zmiennych rokowniczych u chorych, u których po cystektomii rozpoznano przerzuty w węzłach chłonnych.
Wymienione czynniki ryzyka dostarczają cennych informacji dotyczących nawrotów oraz przeżycia, mogą też usprawnić standaryzację klasyfikacjistanuwęzłówchłonnych.Częstośćwystępowania zajęcia węzłów chłonnych, usuwanych podczas radykalnej cystektomii z powodu naciekającego raka pęcherza moczowego, określa się między 14 a 35%. Przedstawia to tabela 1.
Tab. 1
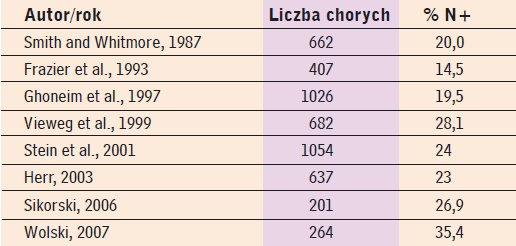
Aktualne dane wskazują, że poprawę przeżycia u przeciętnego chorego można uzyskać usuwając co najmniej 11 węzłów chłonnych (najlepiej 14-15) w porównaniu z usunięciem 10 lub mniej. Usunięcie większej liczby węzłów (>=11) wydłużało przeżycie i zmniejszało częstość nawrotów miejscowych zarówno u chorych z przerzutami węzłowymi, jak i bez nich. Leissner i wsp. w grupie 447 chory odnotowali poprawę przeżycia wówczas, gdy podczas cystektomii usunięto większą (>=16) liczbę węzłów chłonnych. W innym opracowaniu Poulsen i wsp. wykazali, że dzięki rozszerzeniu zakresu wycięcia węzłów chłonnych przeżycie chorych z no-wotworem ograniczonym do narządu i brakiem przerzutów w węzłach jest lepsze w porównaniu z podobną grupą tych, którzy przebyli ograniczoną limfadenektomię. Jest bardzo prawdopodobne, że niezależnie od stanu węzłów rozszerzona limfadenektomia może poprawić przeżycie chorych po cystektomii dzięki usunięciu nierozpoznanych mikroprzerzutów węzłowych. Na liczbę zbadanych węzłów chłonnych - poza jakością operacji i oceny patologicznej - wpływa cały szereg zmiennych. Można do nich zaliczyć: wiek, ogólny stan zdrowia chorego (choroby współistniejące), stopień zaawansowania nowotworu, dotychczasowe leczenie oraz fakt tzw. zmienności osobniczej, tzn., że niektórzy ludzie mają po prostu mniej węzłów chłonnych. Z drugiej strony, w niektórych przypadkach lepiej nie wykonywać PILND, bowiem rozszerzenie zakresu zabiegu może być niebezpieczne, a często niemożliwe (np. gdy chory przebył rozległą operację w obrębie miednicy lub chemio- czy radioterapię z powodu miejscowo zaawansowanych zmian w węzłach chłonnych). Sposobem leczenia typowego chorego z naciekającym guzem pęcherza moczowego, aby zapewnić mu właściwą kontrolę miejscową i wydłużyć przeżycie, jest usunięcie pęcherza wraz z szerokim marginesem tkanki tłuszczowej okołopęcherzowej oraz choćby minimalnej liczby węzłów chłonnych. Optymalna liczba usuwanych węzłów chłonnych jest różna u poszczególnych chorych i chirurg nie może jej przewidzieć przed operacją. Dlatego zabieg ten powinien wykonywać doświadczony operator, który usuwa tyle węzłów chłonnych, ile to tylko możliwe, bez zwiększenia ryzyka operacji. Takie postępowanie wydaje się wybitnie uzasadnione u chorych z niezmienionymi makroskopowo węzłami, jednak dodatnimi w badaniu mikroskopowym. Ogólna liczba zajętych przez nowotwór węzłów chłonnych okazała się ważnym wskaźnikiem rokowniczym. W jednym z opracowań przeżycie chorych z przerzutami w więcej niż 8 węzłach chłonnych było znamiennie gorsze niż przeżycie tych ze zmianami w 8 lub mniej węzłach. Inni badacze przedstawili podobne dane. Wpływ na przeżycie ma nie tylko liczba usuniętych węzłów chłonnych, ale również to, jaki odsetek ogólnej liczby stanowią zajęte węzły. Dla określenia rokowania u chorych na raka pęcherza moczowego wprowadzono pojęcie gęstości węzłów chłonnych. Obejmuje ono jednocześnie oba te czynniki. Mianem tym określa się stosunek liczby węzłów chłonnych z przerzutami do ogólnej liczby usuniętych węzłów chłonnych. Chorzy, u których wartość ta wynosi poniżej 20%, mają lepsze rokowanie, wykazują znacząco lepsze przeżycie 5-letnie i znamiennie niższy wskaźnik nawrotu nowotworu w porównaniu z tymi, u których wskaźnik ten przekroczył 20%. Wskazuje to, że dokładniejsze usunięcie węzłów chłonnych przyczynia się do uzyskania lepszych wyników odległych niż mniej rozległa limfadenektomia. Rozszerzone i skrupulatne obustronne usunięcie węzłów chłonnych powinno obejmować przynajmniej węzły biodrowe wspólne, przedkrzyżowe, przedkulszowe, biodrowe wewnętrzne i zewnętrzne oraz zasłonowe. Takie postępowanie jest proponowane przez Europejskie Towarzystwo Urologiczne dopiero od 2008 roku. Ma ono zasadnicze znaczenie dla całkowitego usunięcia wszystkich ognisk tkanki chłonnej w obszarze pierwszej i drugiej stacji węzłów drenujących pęcherz i powinno zapewnić dokładniejszą ocenę stadium zaawansowania. Podsumowanie Cystektomia radykalna połączona z limfadenektomią miedniczo-biodrową pozostaje podstawowym sposobem leczenia chorych na naciekającego raka pęcherza moczowego. Badania dowodzą, że stopień i/lub doszczętność limfadenektomii mogą przyczynić się do poprawy przeżycia. Nie ma jednak zgodności co do zasięgu wycięcia węzłów chłonnych ani minimalnej liczby węzłów chłonnych, jaką należy usunąć. Zgromadzone dane wskazują jednak, że rozległość tej operacji istotnie wpływa na przebieg choroby. Informacja ta jest ważna nie tylko dla podjęcia decyzji dotyczącej leczenia oraz przewidywania rokowania u każdego z tak leczonych chorych. Jest również istotna dla opracowania i interpretacji wyników prób klinicznych. Na podstawie badań prospektywnych można będzie i należy ustalić standardy wykonywania cystektomii radykalnej i PILND. Doskonalenie techniki chirurgicznej w miejscowo zaawansowanym raku pęcherza moczowego może być równie ważne jak inne, dodatkowe metody leczenia naciekającego raka pęcherza moczowego. lek. med. Michał Bryczkowski
|
