| ||||||||
Wrodzona przeszkoda podmiedniczkowaW ciągu ostatnich 25 lat zaszły ogromne zmiany w diagnostyce i leczeniu wodonercza wrodzonego. Dawniej było ono rozpoznawane w oparciu o urografię,wykonywanąwokresienoworodkowym lub niemowlęcym z powodu urosepsy, lub u dzieci starszych z powodu nawracających zakażeń układu moczowego bądź dolegliwości bólowych zlokalizowanych w okolicy lędźwiowej. Wodonercze, rozpoznane w ten sposób, leczone było operacyjnie. Z czasem podstawowym badaniem diagnostycznym stała się ultrasonografia,a jej wykonywanie u ciężarnych przyniosło prawdziwą rewolucję w wykrywaniu wodonercza wrodzonego. Początkowo większość noworodków kierowana była do leczenia operacyjnego, ale z czasem okres obserwacji postnatalnej ulegał wydłużeniu, a o wdrożeniu postępowania chirurgicznego zaczął decydować stan czynnościowy nerki wodonerczowej, oceniany w badaniu izotopowym [1]. Coraz częściej lekarze zadawali sobie pytanie: Czy i kiedy wodonercze wykryte przypadkowo, bez towarzyszących mu objawów klinicznych, powinno być leczone operacyjnie? Z raportu EUROCAT, opublikowanego w ostatnim numerze Journal of Pediatric Urology [2] wynika, że wśród 3648 przypadków wodonercza wrodzonego 2664 (73%) było rozpoznanych prenatalnie. Wodonercze płodowe stwierdza się u 0,3-0,4% ciężarnych. Za pato-logiczne uważa się poszerzenie miedniczki nerkowej płodu w wymiarze przednio-tylnym (A-P):
Tylko w nielicznych przypadkach wodonercza płodowego istnieją wskazania do interwencji prenatalnej, natomiast we wszystkich konieczne jest przeprowadzenie dalszej diagnostyki u noworodka [3]. Znaczne, obustronne wodonercze płodowe wymaga wykonania USG w pierwszej dobie życia. W pozostałych przypadkach badanie USG powinno być wykonane w 3-4 dobie życia, ze względu na oligurię, która występuje u noworodków w pierwszych 24-48 godzinach po urodzeniu i może być przyczyną fałszywie ujemnego wyniku [4, 5]. Badania postnatalne potwierdzają obecność wodonercza jedynie u 51% noworodków, u których stwierdzano wodonercze w okresie życia płodowego. Wśród przyczyn poszerzenia układu kielichowo-miedniczkowego u noworodków przeszkoda podmiedniczkowa stanowi 43%, odpływy pęcherzowo-moczowodowe - 24%, zastawki cewki tylnej - 12%, zwężenie przypęcherzowe - 11%, a zdwojenie moczowodów - 10%. Następstwem obecności przeszkody podmiedniczkowej jest zastój moczu w miedniczce nerkowej i w kielichach, prowadzący do zwięk-szenia ich wymiarów, a niekiedy także do upośledzenia funkcji nerki. Przeszkoda może mieć charakter anatomiczny lub czynnościowy. Przeszkodę anatomiczną stanowić może zwężenie połączenia miedniczkowo-moczowodowego (PMM) wynikające z niedoboru mięśniówki okrężnej lub przerostu włókien kolagenowych, wysokie odejście moczowodu, zastawka moczowodu tuż poniżej PMM, naczynie biegunowe uciskające PMM lub powodujące przewieszanie się moczowodu, a także moczowód płodowy i zagięcie moczowodu. Wśród wymienionych przyczyn wodonercza dwie ostatnie zajmują szczególne miejsce, ponieważ mogą ustąpić samoistnie. Moczowód płodowy charakteryzuje się obecnością fałdów śluzówkowych układających się spiralnie, które są często widoczne u płodów i mogą przetrwać do okresu noworodkowego, a niekiedy nawet dłużej. Stanowią one rodzaj „rezerwy wzrostowej” i ulegają zwykle samoistnemu wyprostowaniu wraz ze wzrostem dziecka. Zagięcie moczowodu w odcinku podmiedniczkowym (tzw. syfon) jest zwykle następstwem odpływu pęcherzowo-moczowodowego lub przeszkody w połączeniu moczowodowo-pęcherzowym. Wysokie ciśnienie panujące w moczowodzie powoduje jego rozciągnięcie nie tylko na szerokość, ale także na długość, czego skutkiem jest kręty przebieg moczowodu, zaczynający się zwykle wygięciem tuż poniżej PMM. Wyeliminowanie przeszkody lub odpływu wstecznego daje w konsekwencji wyprostowanie się moczowodu i ustąpienie objawów wodonercza. Czynnościowa przeszkoda podmiedniczkowa jest następstwem zaburzeń unerwienia ściany miedniczki i początkowego odcinka moczowodu, a także deficytuośrodkówrozrusznikowychreprezentowanych przez komórki Cajala. W piśmiennictwie ostatnich lat pojawia się coraz więcej doniesień opisujących zaburzenia unerwienia jako główną przyczynę wodonercza wrodzonego u dzieci. Nemeth [6] stwierdził, że w zwężeniu połączenia miedniczkowo-moczowodowego u dzieci dochodzi do znacznego zmniejszenia liczby włókien nerwowych w tym obszarze, a szczególnie w obrębie warstwy mięśniowej ściany moczowodu. Liczba włókien nerwowych w błonie podśluzowej jest również mniejsza, choć nie tak znacznie jak w błonie mięśniowej. Z analizy danych wynika, że pod-miedniczkowy odcinek moczowodu, pozbawiony prawidłowego unerwienia koordynującego jego motorykę, utrudnia opróżnianie miedniczki nerkowej i prowadzi do wodonercza. Zaburzenia czynnościowe u noworodków i niemowląt mogą ustąpić samoistnie wraz z dojrzewaniem układu nerwowego. Plastyka miedniczkowo-moczowodowa może nie tylko nie przynieść poprawy, ale wręcz pogorszyć pasaż moczu. Niestety, charakter przeszkody określany jest najczęściej dopiero w trakcie operacji.
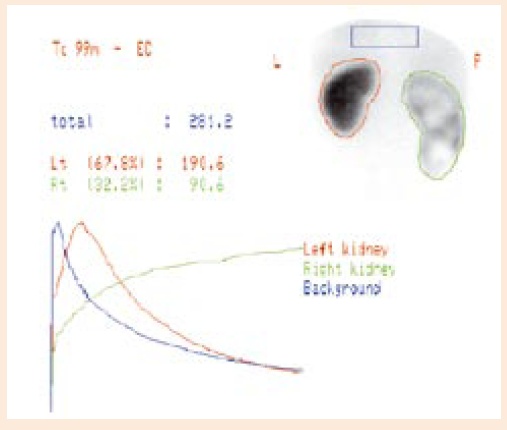
Ryc. 1 Wodonercze nerki prawej z upośledzeniem funkcji i jej 32,2% udziałem w oczyszczaniu - wskazane leczenie operacyjne
Ryc. 2 Wodonercze nerki prawej z dobrą funkcją i jej 47,1% udziałem w oczyszczaniu - wskazana dalsza obserwacja
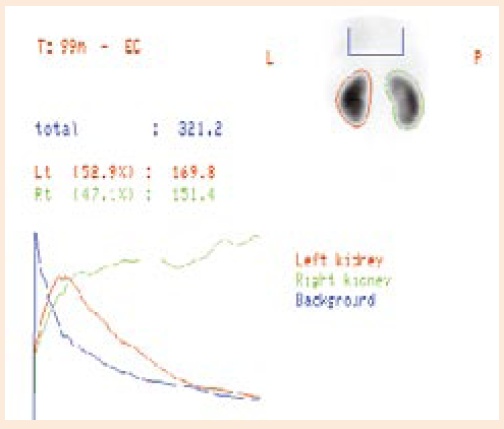
Decyzja o podjęciu interwencji chirurgicznej zależy od stopnia poszerzenia układu kielichowo-miedniczkowego i grubości miąższu, ocenianych w badaniach USG oraz od rozdzielczej funkcji nerki i testu diuretycznego wykonanego podczas renoscyntygrafii(ryc.1i 2) [7]. Kontrowersje w interpretacji tych badań dotyczą właściwego nawodnienia pacjenta, stanu wypełnienia pęcherza oraz braku jednoznacznej definicjinieprawidłowegoodpływumoczu[8,9]. Obserwacje kliniczne wykazały, że interwencja chirurgiczna konieczna była jedynie u 2% dzieci, u których w okresie noworodkowym poszerzenie miedniczki w wymiarze A-P nie przekraczało 20 mm i aż u 80% dzieci z poszerzeniem powyżej 40 mm, dochodząc do 100% w przypadku poszerzenia powyżej 50 mm [10]. Odpowiedź na pytanie, kiedy należy wkraczać operacyjnie wciąż budzi kontrowersje. Niektórzy uważają, że interwencja chirurgiczna jest konieczna w przypadku upośledzenia rozdzielczej funkcji wodonerczowej nerki poniżej 40%, inni, że poniżej 35%, a jeszcze inni, że dopiero wówczas, kiedy występuje pogarszanie się czynności nerki o 10% [4, 10, 11]. Przyczyną kontrowersji i dylematów przy podejmowaniu decyzji jest brak badania potwierdzającego istnienie przeszkody anatomicznej, którą należy usunąć. W 1978 roku Whitaker [12] zaproponował test polegający na pomiarach ciśnienia śródmiedniczkowego i śródpęcherzowego, których różnica wskazywałaby na obecność rzeczywistej przeszkody. Test nie spełnił pokładanych w nim nadziei i z czasem nawet sam autor zaprzestał jego stosowania. W Klinice Urologii Dziecięcej IP-CZD powstał projekt, którego autorzy chcą ustalić, czy i jaka jest zależność pomiędzy stanem uner-wienia miedniczki i początkowego odcinka moczowodu a oceną makroskopową przeszkody w połączeniu miedniczkowo-moczowodowym oraz izotopowymi wskaźnikami tranzytu miąższowego. praktykaW projekcie planowana jest ocena unerwienia fragmentu miedniczki, połączenia miedniczkowo-moczowodowego oraz początko-wego odcinka moczowodu, usuniętych podczas operacji naprawczej wodonercza metodą Hynes-Andersona. Ocena ta będzie dokonana w oparciu o badanie ekspresji białek Protein Gene Product (PGP 9.5) i Nerve Growth Factor Receptor (NGF-R) oraz ekspresji białka c-kit dla komórek rozrusznikowych Cajala. Kwalifikacjadoleczeniaoperacyjnego oparta będzie na klasycznych wskazaniach, uwzględniających objawy, wyniki badań USG i badań izotopowych nerek [7, 11]. Na podstawie badań renoscyntygraficznych, przy użyciu etylenodicysteiny (EC) znakowanej Tc 99m, zostanie wykonane oznaczenie wskaźników tranzytu miąższowego [13]. Wyniki badań będą poddane analizie statystycznej z uwzględnieniem makroskopowej oceny charakteru przeszkody dokonanej przez chirurga podczas operacji. W planowanym badaniu chcemy ocenić zależność między wskaźnikami tranzytu miąższowego a obrazem makroskopowym połączenia miedniczkowo-moczowodowego oraz stanem unerwienia tego połączenia, w celu ewentualnego przyszłego ustalania charakteru przeszkody i wskazań do interwencji chirurgicznej w oparciu o izotopowe wskaźniki tranzytu miąższowego. doc. dr hab. med. Małgorzata Baka-Ostrowska, FEAPU
|
