- Pięcioletnie przeżycie chorych na raka nerkowokomórkowego
sięga 62%. Śmiertelność z powodu tego nowotworu przewyższa
śmiertelność z powodu innych nowotworów "urologicznych".
- W momencie rozpoznania choroby przerzuty stwierdza się
u 20-30% osób.
- Przerzuty rozwijają się u 20-40% chorych poddanych
nefrektomii wykonanej z powodu raka ograniczonego
do nerki.
- Klasyczne formy chemioterapii, radioterapii lub hormonoterapii
nie mają wpływu na przebieg raka nerkowokomórkowego
z przerzutami.
- Odpowiedź na immunoterapię występuje u 15-25% leczonych.
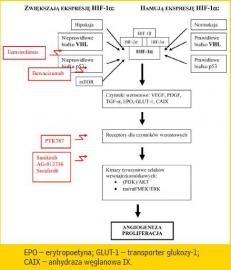
Molekularne podstawy rozwoju raka nerkowokomórkowego
Zasadnicze znaczenie dla rozwoju raka nerkowokomórkowego
ma nadmierna ekspresja czynników wzrostu, a w szczególności:
naczyniowo-śródbłonkowego czynnika wzrostu (VEGF - vascular
endothelial growth factor), płytkopochodnego czynnika wzrostu
(PDGF - platelet derived growth factor), transformującego czynnika
wzrostu alfa (TGF-α - transforming growth factor-α;) itp.
Ekspresja wymienionych czynników kontrolowana jest przez czynnik
indukowany niedotlenieniem (HIF - hypoxia inducible factor).
Jego podjednostka beta (HIF-1β) produkowana jest w stałym tempie,
natomiast ekspresja podjednostki alfa (HIF-1α) podlega regulacji.
W warunkach normoksemicznych i przy niezaburzonej
ekspresji prawidłowego białka von Hippel-Lindau'a (pVHL) stężenie
HIF-1α, a zarazem stężenie czynników wzrostu, jest niskie.
W warunkach niedoboru tlenu lub w wyniku mutacji genu VHL
zwiększa się ilość HIF-1α, co stymuluje ekspresję czynników
wzrostu (ryc. 1).
|
Miejsca uchwytu nowych leków stosowanych do leczenia raka nerkowokomórkowego |
 |
U większości chorych na raka jasnokomórkowego nerki stwierdza
się uszkodzenie obu alleli genu supresorowego von Hippel-
-Lindau'a. U 40% chorych, u których występuje zespół von Hippel-
-Lindau'a, dochodzi do rozwoju jasnokomórkowego raka nerki.
Inne typy histologiczne raka nerkowokomórkowego nie są związane
z genem VHL.
Inne czynniki regulujące ekspresję HIF-1α:
- szlak: kinaza fosfatydyloinozytolu-3 / AKT (PI3K/AKT)
- mTOR (mammalian target of rapamycin)
- transformujący gen wirusa mięsaka Rousa
- czynniki wzrostu podobne do insuliny typu I i II
- nabłonkowy czynnik wzrostu (EGF - epithelial growth factor)
- gen supresorowy PTEN
- p53
Czynniki wzrostu, łącząc się ze swoimi receptorami, powodują
aktywację dwóch szlaków kinaz tyrozynowych: (PI3K)/AKT
i ras/raf/MEK/ERK. Ich aktywacja prowadzi do proliferacji komórek
i ekspresji białek koniecznych dla rozwoju guza.
Przegląd nowoczesnych metod leczenia
I. Leczenie przeciwciałami
Przeciwciało G250 rozpoznaje antygen błonowy występujący
swoiście na komórkach raka nerkowokomórkowego, a nie występujący
na komórkach prawidłowego nabłonka kanalików proksymalnych.
Zakończono badania II fazy nad stosowaniem G250
w połączeniu z interleukiną-2 w małej dawce. Stwierdzono, że ten
sposób leczenia charakteryzuje się lepszym profilem bezpieczeństwa
i skutkuje przeżyciem porównywalnym do uzyskiwanego
u leczonych cytokinami stosowanymi obecnie.
II. Szczepionki
Przeprowadzono badania nad trzema typami szczepionek:
- z izolowanych, autologicznych komórek raka - 5-letni okres
wolny od progresji u 77,4%, zaś w grupie kontrolnej u 67,8%;
szczepionka była dobrze tolerowana; nie jest zarejestrowana.
- z komórek guza modyfikowanych genetycznie;
- z komórek dendrytycznych prezentujących antygeny raka
nerkowokomórkowego - niezbyt zachęcające wyniki zbliżone
do osiąganych u leczonych jedną cytokiną.
III. Leczenie skierowane przeciw VEGF
Bewacizumab (Avastin®, Roche) - monoklonalne, humanizowane przeciwciało wiążące VEGF; jego zastosowanie powoduje zmniejszenie
ilości krążącego w surowicy VEGF.
PTK787 (Schering) - selektywny inhibitor kinaz tyrozynowych
związanych z receptorami dla VEGF: VEGFR-1, VEGFR-2
i VEGFR-3.
Sunitinib (Sutent®, Pfizer), Sorafenib (Nexavar®, Bayer) i AG-013736
(Pfizer) - inhibitory kinaz tyrozynowych związanych z wieloma
receptorami, w tym dla VEGF i PDGF; wyniki stosowania tych
leków w próbach klinicznych są następujące:
- AG-013736
Częściową odpowiedź zaobserwowano u 46% pacjentów, a stabilizację
choroby u 40% - u 38% z nich stwierdzono zmniejszenie
wymiarów guza o mniej niż 1/3 wymiaru. Oczekiwana mediana
czasu do wystąpienia progresji wynosi 22-24 miesiące. Dzia łaniami
niepożądanymi o największym nasileniu były: nadciśnienie
tętnicze (15%), biegunka i uczucie zmęczenia (8%) - działania
niepożądane spowodowały wycofanie się 12% leczonych z badań.
- Sunitinib
Stosowany w dawce 50 mg na dobę w cyklach 6-tygodniowych: 4 tygodnie
stosowania leku codziennie, potem 2 tygodnie przerwy.
Wśród leczonych tym lekiem w ramach leczenia drugiego rzutu
odpowiedź częściową stwierdzono u ok. 40% z nich, a stabilizację
choroby u ok. 25%. Odpowiedź całkowita wystąpiła tylko u jednego
chorego. Sunitinib został zarejestrowany przez amerykańską
agencję Food and Drug Administration (FDA) do leczenia II rzutu
zaawansowanego raka nerkowokomórkowego.
W leczeniu pierwszego rzutu porównano sunitinib z interferonem
alfa: czas wolny od progresji wyniósł odpowiednio 47 i 25 tygodni,
odpowiedź na leczenie stwierdzono odpowiednio u 31%
i u 6% chorych. Z powodu działań niepożądanych wycofało się
8% leczonych sunitinibem i 13% interferonem alfa.
Działania niepożądane: zmniejszenie frakcji wyrzutowej serca
i nadciśnienie tętnicze występowały najczęściej, nieco rzadziej
leukopenia, anemia, trombocytopenia i hiperlipidemia. Dawkę
leku zredukowano u 35% i 22% chorych w dwóch kolejnych badaniach.
- Sorafenib
Lek podawany doustnie w dawce 400 mg dwa razy dziennie w monoterapii
lub w skojarzeniu z interferonem alfa 2b stosowano
u chorych na raka nerkowokomórkowego, którzy nie odpowiedzieli
na wcześniejsze leczenie systemowe.
Połączenie sorafenibu z interferonem alfa przyczyniło się do zwiększenia
odsetka odpowiedzi częściowych do 37%, a stabilizację
choroby obserwowano u kolejnych 47%.
Działania niepożądane: wysypka, złuszczanie naskórka, zespół
ręka-stopa (erytrodyzestezja dłoniowo-podeszwowa - hand-foot
skin reaction), zmęczenie, biegunka. Rzadziej obserwowano zapalenie
błony śluzowej żołądka, zaburzenia wzwodu, łysienie
lub zmianę koloru i struktury włosów (siwienie i kręcenie się).
Z powodu działań niepożądanych z badań wycofało się 10% leczonych
sorafenibem i 8% otrzymujących placebo; dawkę sorafenibu
zmniejszono u 12% chorych, najczęściej z powodu biegunki
i reakcji skórnej rąk i stóp. Dołączenie interferonu zwiększyło
częstość występowania działań niepożądanych, ale ich nasilenie
było niewielkie.
|
Leczenie raka nerkowokomórkowego z przerzutami |
 |
IV. Leczenie skierowane przeciw EGF
- Gefitinib - selektywny inhibitor kinazy tyrozynowej związanej
z receptorem dla EGF; brak skuteczności u chorych na raka nerkowokomórkowego.
- Cetuximab - rekombinowane przeciwciało monoklonalne;
w badaniach klinicznych nie uzyskano korzystnych wyników.
- ABX-EGF - przeciwciało skierowane przeciw receptorowi
dla EGF; wyniki umiarkowanie zachęcające: stabilizacja choroby
u 50% leczonych, odpowiedź na leczenie u kilku chorych. Najczęstszym
działaniem niepożądanym była wysypka.
Małą skuteczność wymienionych leków można tłumaczyć niewielką
częstością występowania mutacji w genie receptora dla EGF
w raku nerkowokomórkowym. Jednocześnie, w wyniku mutacji
genu VHL następuje wzmożona ekspresja VEGF i TGF-alfa,
które rozregulowują działanie receptorów VEGFR i EGFR tak, że
selektywne blokowanie jednego z nich (EGFR) staje się niewystarczające.
V. Leczenie skierowane przeciw mTOR
mTOR (mammalian target of rapamycin) jest kinazą odpowiedzialną
za regulację procesu translacji w czasie angiogenezy i rozwoju
komórek. Między innymi wpływa na działanie podjednostek
alfa białka HIF. Jej działanie konieczne jest do przejścia komórek
z fazy G0/G1 w fazę S.
Znanym inhibitorem mTOR jest Sirolimus (Rapamycyna), doustny
lek immunosupresyjny stosowany w transplantologii. Jego
dożylnym analogiem jest Temsirolimus.
Temsirolimus (25 mg iv raz na tydzień) przeszedł badania II i III fazy
w leczeniu pierwszego rzutu zaawansowanego raka nerkowo-komórkowego. Stwierdzono znamiennie dłuższy czas przeżycia
niż dla interferonu (10,9 vs 7,3 miesiąca) oraz dłuższy czas do progresji
(3,9 vs 1,9 miesiąca).
Działania niepożądane: osłabienie, niedokrwistość i duszność,
rzadziej wysypka, zapalenie błony śluzowej żołądka, biegunka,
wymioty i obrzęki obwodowe, małopłytkowość, hiperglikemia,
hipercholesterolemia.
VI. Leczenie skojarzone
Bewacizumab + erlotinib (inibitor EGFR) wydają się mieć razem
większą aktywność niż każdy z nich osobno. Dodanie imatinibu
(inhibitor PDGF-beta) tylko zwiększyło toksyczność terapii.
Całkowite przeżycie po 18 miesiącach wyniosło 60%.
Oprac. lek. Bartosz Dybowski
Katedra i Klinika Urologii AM w Warszawie
kierownik kliniki: prof. Andrzej Borkowski
