Zapobieganie uszkodzeniom tkanki kostnej oraz ich leczenie u chorych na raka gruczołu krokowego - zagadnienia wybrane
Katedra i Klinika Urologii i Onkologii Urologicznej
Akademia Medyczna we Wrocławiu
kierownik katedry: prof. dr hab. n. med. Romuald Zdrojowy
Rak gruczołu krokowego (PCa - prostatic cancer) jest w Polsce najczęściej
występującym nowotworem układu moczowo-płciowego u mężczyzn. Liczba diagnozowanych rocznie przypadków stale rośnie [1].
Jednym z istotnych problemów związanych z naturalnym rozwojem
choroby oraz z następstwami leczenia są powikłania ze strony układu
kostnego. Z jednej strony kości są najczęstszym miejscem tworzenia się
zmian przerzutowych, a z drugiej - stosowanie terapii polegającej
na ablacji androgenowej zwiększa ryzyko powstania osteoporozy
z wszystkimi jej konsekwencjami [2]. Komplikacje kostne mogą skracać
czas życia chorych, a także pogarszają jego jakość [3].
Przerzuty do kości
W momencie rozpoznania około 5% chorych na raka gruczołu krokowego
ma przerzuty odległe (TxNxM1). Przerzuty w kościach (TxNxM1b)
pojawiają się u około 35% chorych na PCa oraz stwierdza się je
u 80-100% chorych, którzy zmarli z jego powodu [4]. Stanowią one
około 90% wszystkich przerzutów PCa powstających drogą krwionośną. Najczęściej umiejscowione są w kręgosłupie (90% wszystkich
przerzutów do kości); przerzuty umiejscowione są także w żebrach,
miednicy, kościach długich oraz czaszce [5].
Obecność przerzutów do kości może powodować ból, złamania patologiczne,
kompresję rdzenia kręgowego, supresję szpiku kostnego,
hipo- i hiperkalcemię. Przerzuty mogą prowadzić do skrócenia okresu
przeżycia, upośledzenia jakości życia oraz wzrostu kosztów leczenia [6].
Jakimi metodami leczenia chorych na PCa z przerzutami do kości
dysponujemy dzisiaj? Czy istnieją metody zapobiegania rozwojowi
przerzutów?
Bifosfoniany
Bifosfoniany są związkami chemicznymi, w których budowie charakterystyczne
jest występowanie dwóch reszt fosforanowych połączonych
ze sobą za pomocą atomu węgla. Dzięki istnieniu tego ugrupowania
bifosfoniany wykazują wysokie powinowactwo do zjonizowanych
dwuwartościowych atomów metali, np. jonu Ca2+. Po połączeniu z nim
są one szybko usuwane z krwiobiegu i gromadzą się wybiórczo w kościach,
w miejscach o nasilonym remodelingu, szczególnie ulegającym
resorpcji przez osteoklasty. Dochodzi do internalizacji bifosfonianów
przez komórki kościogubne i na drodze indukcji apoptozy do ich
niszczenia, co hamuje resorpcję kości.
Nieco inne działanie, znacznie silniejsze od prostych bifosfonianów,
mają bifosfoniany zawierające w swoim łańcuchu bocznym atom azotu
(pamidronian, alendronian, ibandronian, zoledronian, minodronian
oraz risedronian). Działają one głównie na drodze hamowania jednego
z enzymów szlaku kwasu mewalonowego (syntazy pirofosforanu farnezylu),
co prowadzi do zahamowania produkcji wielu molekuł niezbędnych
do funkcjonowania komórki (m.in. Ras, Rho, Rab i innych)
[7]. Hamowany enzym występuje w wielu typach komórek, w tym także
w komórkach PCa. Istnieje zatem możliwość działania bifosfonianów,
oprócz wpływu na osteoklasty, także i na te komórki. Badania
laboratoryjne dowiodły proapoptotycznych własności bifosfonianów,
co zainicjowało przeprowadzenie kilku badań klinicznych [7]. Obecnie
sprawdzany jest wpływ kwasu zoledronowego (badanie AZURE),
a także kwasu zoledronowego w porównaniu z klodronianem oraz
rizedronianem (SWOG 0307/intergroup) u kobiet chorych na raka
gruczołu piersiowego. Badacze mają nadzieję wykazać działanie
hamujące powstawanie przerzutów. Jaką rolę będą miały te substancje
u chorych na PCa, pokaże przyszłość.
W klinice bifosfoniany znalazły zastosowanie w leczeniu osteoporozy
oraz powikłań przerzutów nowotworowych do kości. Przeprowadzono
kilka prospektywnych badań, w których wykazano przydatność niektórych
bifosfonianów do leczenia chorych na PCa z przerzutami (tab. 1).
|
Wyniki 5 prospektywnych badań
klinicznych nad przydatnością bifosfonianów u chorych na raka stercza z przerzutami do kości |
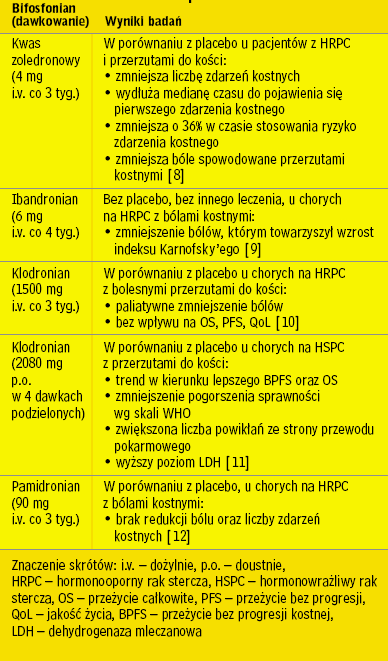 |
W 2004 r. opublikowano na łamach The American Journal of Urology
Review konsensus dotyczący stosowania dożylnego bifosfonianów
w zapobieganiu powikłaniom kostnym u chorych na zaawansowanego
PCa. Według wytycznych, jedynym bifosfonianem o udowodnionej
skuteczności w leczeniu chorych na hormonoopornego raka
stercza (HRPC) z przerzutami do kości jest kwas zoledronowy i tylko
jego użycie jest zalecane przez ekspertów. Jako badanie weryfikujące
obecność przerzutów kostnych zaleca się scyntygrafię kości [13].
F. Saad i wsp. udowodnili w badaniu, na którego wynikach oparto zalecenia,
zmniejszenie liczby powikłań kostnych u chorych przyjmujących zoledronian w porównaniu z chorymi z grupy placebo. Doszło
do zmniejszenia częstości występowania incydentów kostnych, niezale
żnie od tego, czy takie zdarzenie wystąpiło jeszcze przed przystąpieniem
do badania czy nie. Wydłużyła się mediana czasu do wystąpienia
incydentu kostnego, zmniejszyło się nasilenie bólów kostnych spowodowanych
przerzutami [8]. Na tej podstawie panel ekspertów zalecił
stosowanie kwasu zoledronowego w dawce 4 mg co 3-4 tygodnie
w 15-minutowym wlewie dożylnym u wszystkich chorych na HRPC
z przerzutami do kości niezależnie od tego, czy przerzuty są objawowe
czy nie. Leczenie to powinno być kontynuowane u wszystkich
chorych niezależnie od zastosowania innych metod leczenia (chemioterapia,
radioterapia i in.) W wymienionym konsensusie autorzy zalecają także zastosowanie kwasu zoledronowego według tego samego
schematu u chorych na HRPC bez przerzutów kostnych, jednak po
rozważeniu przez lekarza korzyści i ryzyka oraz pod ścisłym nadzorem
[13].
|
Algorytm postępowania w hormonoopornym raku stercza (HRPC) z przerzutami do kości i bez objawów |
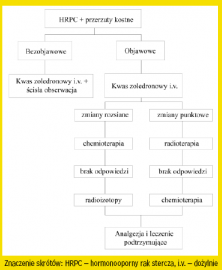 |
Autorzy odpowiedzieli także na pytanie, czy stosować kwas zoledronowy
u chorych na hormonowrażliwego raka gruczołu krokowego
(HSPC) z przerzutami kostnymi. Zalecenia dla tej grupy chorych
oparto na ekstrapolacji wyników badania Saada i wsp. [8] oraz badań
przeprowadzonych u pacjentów z innymi nowotworami, między innymi
rakiem gruczołu piersiowego, płuca oraz szpiczakiem mnogim
[14, 15]. Z powodu braku badań skuteczności kwasu zoledronowego
u chorych na HSPC z przerzutami kostnymi, eksperci stwierdzili,
że nie należy rutynowo stosować zoledronianu u tych chorych,
ale należy rozważyć jego wdrożenie [13]. Na taką rekomendację wpłynę
ło kilka przesłanek, które przemawiają za istotnym działaniem kwasu
zoledronowego na przerzuty kostne, niezależnie od typu nowotworu
i stopnia jego zaawansowania:
(i) Korzystny wpływ kwasu zoledronowego na układ kostny u kobiet
chorych na raka piersi jest niezależny od stopnia zaawansowania
choroby oraz od typu stosowanego leczenia (hormonalne lub chemioterapia).
(ii) U chorych na szpiczaka mnogiego bifosfoniany są rutynowo stosowane
w zapobieganiu i leczeniu powikłań kostnych - najsilniejsze
udowodnione działanie wykazały kwas zoledronowy oraz pamidronian
stosowany dożylnie [16].
(iii) Zoledronian wpływa ponadto korzystnie na układ kostny chorych
poddanych deprywacji androgenowej - hamuje zmniejszanie się gęstości
mineralnej kości (BMD), co zmniejsza liczbę powikłań kostnych
w czasie leczenia hormonalnego.
(iv) Kwas zoledronowy jest dobrze tolerowany, a najczęstsze działania
niepożądane dotyczą układu pokarmowego oraz mają charakter
objawów grypopodobnych, tak jak działania niepożądane innych
bifosfonianów.
|
Schemat użycia kwasu zoledronowego u chorych na raka stercza, wg Saada |
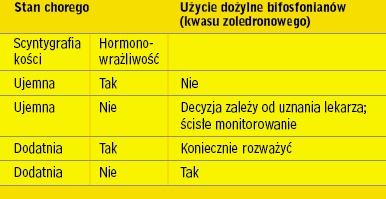 |
Oprócz kwasu zoledronowego dostępnych na rynku jest także kilka
innych substancji z tej grupy. W polskiej praktyce klinicznej mężczyźni
z hormonoopornym rakiem stercza z przerzutami do kości często
otrzymują pamidronian. Istnieją racjonalne podstawy takiego postępowania.
Główną zaletą preparatów pamidronianu jest ich niski koszt
dla pacjenta (zryczałtowana opłata 3,20 PLN za dawkę), podczas
gdy kwas zoledronowy jest ponad 500 razy droższy (ok. 1800 PLN
za dawkę) i przez to nieosiągalny dla większości. Pamidronian okazał się także skutecznym lekiem w szpiczaku mnogim oraz raku gruczołu piersiowego z przerzutami do kości. Budzi to zatem podejrzenie
i nadzieję, że może on wykazywać się podobnym działaniem także
w raku stercza. Sherer i wsp. w niedawno opublikowanej pracy porównują skuteczność pamidronianu i zoledronianu u mężczyzn z przerzutowym
rakiem stercza [17]. Autorzy stwierdzają, iż nie ma definitywnej
różnicy w skuteczności obu tych związków. Pomimo iż interesująca, praca ta ma jednak wiele ograniczeń. Badanie zostało przeprowadzone
retrospektywnie w jednym ośrodku bez ślepej próby, a wszystkie
wymagane kryteria włączenia spełniło zaledwie 24 mężczyzn (po
rozluźnieniu kryteriów 105). Porównanie siły statystycznej tego badania,
a także badań Small i wsp. [12] oraz Saad i wsp. [8], mimo iż badali oni
odpowiednio pamidronian i zoledronian vs. placebo, a nie obie substancje
między sobą, wypada zdecydowanie niekorzystnie dla Sherer i wsp.
Mimo to badania w tym kierunku powinny być kontynuowane.
Innym powodem podawania pamidronianu mężczyznom z przerzutami
raka stercza do kości, jest bardzo częste współwystępowanie
u nich zarówno przerzutów, jak i osteoporozy. Czy zastosowanie u tych
mężczyzn pamidronianu w celu leczenia zmian osteoporotycznych
daje pozytywne efekty, nie wiadomo. Dostępne wytyczne zalecają kwas
zoledronowy jako jedyny bifosfonian o udowodnionej skuteczności
w leczeniu mężczyzn z przerzutami raka stercza do kości.
Inne bifosfoniany dostępne na rynku podobnie jak pamidronian wykaza
ły swoją skuteczność w różnych typach nowotworów, co spowodowa
ło zainteresowanie nimi także w kontekście leczenia rozsianego
raka gruczołu krokowego. Pomimo zachęcających wyników badań
wstępnych nie udowodniono jednak ich pozytywnego efektu w dużych
randomizowanych badaniach, a w odniesieniu do niektórych bifosfonianów
badań takich nie przeprowadzono.
Radioterapia
Radioterapia jest często stosowanym postępowaniem w paliatywnym
leczeniu przerzutów kostnych PCa oraz innych nowotworów. W zależności od typu zmian kostnych (pojedyncze - zlokalizowane lub
wieloogniskowe - rozproszone) istnieje możliwość zastosowania
różnych metod napromieniania.
EBRT
Radioterapia ze źródła zewnętrznego (EBRT - external beam radiotherapy,
teleradioterapia) polega na napromienianiu ognisk przerzutowych
z zewnętrznego źródła promieniowania. Tę formę leczenia
miejscowego stosuje się zwłaszcza w przypadku pojedynczych, ograniczonych
przerzutów zarówno do kości, jak i do tkanek miękkich.
Wskazaniami do jej stosowania są przede wszystkim bóle, zwłaszcza
słabo poddające się leczeniu farmakologicznemu, złamania patologiczne,
objawy kompresji rdzenia kręgowego, ale także profilaktycznie
stany zagrażające złamaniem patologicznym lub uciskiem korzenia
nerwowego bądź rdzenia kręgowego [17]. Efekt przeciwbólowy uzyskuje
się najwcześniej po 48-72 godzinach od napromienienia, ale u wielu
chorych efekt ten rozwija się nawet do 4 tygodni. Zmniejszenie dolegliwości
obserwuje się u 70-85% chorych, z czego u około 50% całkowite
ich ustąpienie. Korzystny efekt utrzymuje się od 3 do 12 miesięcy
[17]. Optymalna dawka oraz sposób frakcjonowania nie zostały dotychczas
ściśle określone. Najczęściej stosowane są schematy: 40-46 Gy
w 20-23 frakcjach, 30 Gy w 10 frakcjach, 24 Gy w 6 frakcjach, 20 Gy
w 5 frakcjach, 8 Gy w 1 sesji napromieniania. W badaniu Radiation
Therapy Oncology Group (RTOG badanie 7402, protokół 88-22)
stwierdzono większą skuteczność dawki 40 Gy niż 25 Gy. U około
1/3 chorych możliwe i czasem konieczne jest dodatkowe napromienianie
ze względu na nawrót dolegliwości.
W przypadku mnogich ognisk przerzutowych w kościach istnieje odmiana
teleradioterapii z zastosowaniem szerokiego pola naświetlania
- tzw. metoda naświetlania połowy ciała (HBI - hemibody s. half body
irradiation). Polega ona na naświetleniu ze źródła zewnętrznego górnej
lub dolnej połowy ciała. Stosowane dawki jednorazowe wynoszą 6 Gy
(dla połowy górnej) i 8 Gy (dla połowy dolnej). Zaletą tej metody
jest szybkie (24-48 godz.) pojawianie się efektów, wadą zaś duża
toksyczność, objawiająca się supresją szpiku kostnego, zaburzeniami
żołądkowo-jelitowymi oraz popromiennym zapaleniem płuc [17].
Radioizotopy promieniotwórcze
Alternatywą HBI w przypadku zmian wieloogniskowych jest podanie
dożylne radioizotopu. W porównaniu z metodą wymienioną wyżej
jest to leczenie mniej toksyczne, a o porównywalnej, niekiedy nieco
większej skuteczności. Najczęściej stosowanymi i mającymi najlepiej
udowodnione działanie są izotopy: stront-89 i samar-153. W fazie
badań klinicznych znajdują się ponadto: cyna-117m, ren-188 i ren-186
oraz fosfor-32. W 1998 r. opublikowano wytyczne stosowania strontu89 u chorych na PCa z przerzutami do kości [18]. Zostały one
oparte na 4 randomizowanych badaniach klinicznych II i III fazy.
Zaleca się w nich zastosowanie strontu-89 u chorych z wieloogniskowymi
zmianami kostnymi, gdy niemożliwa jest wielopolowa radioterapia
celowana. Nie poleca się jednak tego izotopu jako uzupełnienia
EBRT. W innym opracowaniu zbiorczym [19], w którym poddano
analizie kilkadziesiąt badań klinicznych, autorzy zalecają użycie
strontu-89 lub samaru-153 u chorych z mnogimi, bolesnymi przerzutami
nowotworowymi do kości, u których kontrola bólu za pomoc
ą analgetyków jest niesatysfakcjonująca, a napromienianie lokalne
lub HBI są niewskazane. Decydując o rozpoczęciu terapii tymi izotopami,
należy wziąć pod uwagę funkcję szpiku kostnego, sprawność
chorego, uprzednie stosowanie leczenia mielotoksycznego, alternatywne
metody postępowania oraz oczekiwany czas życia chorego.
Nowym, interesującym kierunkiem badań jest zastosowanie przeciwcia
ł znakowanych izotopami promieniotwórczymi. Trwają badania
nad przeciwciałami przeciwko różnym epitopom komórek PCa znakowanych
różnymi pierwiastkami. Na podstawie dostępnych w piśmiennictwie
danych nie można na razie określić przydatności tych
związków do leczenia PCa z przerzutami [20].
Leczenie ortopedyczne
Leczenie ortopedyczne wskazane jest głównie w przypadku zagrażaj
ących lub dokonanych złamań patologicznych. Najistotniejszy problem
u mężczyzn z przerzutami PCa do kości stanowią przerzuty
do kręgosłupa. Z jednej strony rosnące masy guza mogą uciskać rdzeń
kręgowy, a z drugiej - powodować niestabilność, której efektem jest
złamanie i ucisk rdzenia przez odłamy kostne. Tego typu powikłania
nieleczone lub leczone nieprawidłowo, a także leczone niewystarczająco szybko, mogą prowadzić do porażeń i niedowładów oraz dysfunkcji zwieraczy. Zabieg operacyjny należy przeprowadzić w ciągu 6 godzin od złamania, co pozwala uniknąć utrwalenia się zmian neurologicznych
[17].
Ważne jest przewidzenie ryzyka złamania patologicznego - jeśli radiogramy
wykazują, że przerzut obejmuje 40% obszaru trzonu kręgu,
ryzyko złamania wynosi 80-90%. Wskazania "radiologiczne" do profilaktycznego
stabilizowania operacyjnego kręgosłupa obejmują deformację
i obniżenie o połowę wysokości trzonu, obejmujące nie więcej
niż 2 kręgi. Wskazania kliniczne to: uporczywe bóle, niestabilność kręgosłupa, zaburzenia czucia, niedowłady, zaburzenia funkcji zwieraczy
oraz porażenia, niezależnie od tego, czy miały początek ostry, czy rozwijają się stopniowo. Dzięki profilaktycznym zabiegom stabilizacyjnym
możliwe staje się uniknięcie unieruchomienia chorego i związanych
z tym konsekwencji (osłabienie i zaniki mięśniowe, bóle, odleżyny, zmiany
zapalne płuc, zakażenie układu moczowego, niewydolność krążenia
oraz długi czas hospitalizacji) [17].
Osteoporoza jatrogenna
Od ponad 60 lat leczenie antyandrogenowe (ADT - androgen deprivation
therapy) chorych na PCa jest jedną z fundamentalnych metod
leczenia. Stosuje się ją u chorych na PCa w stadium zaawansowania
regionalnego lub ogólnego, w przypadku niepowodzenia leczenia radykalnego,
przed radioterapią radykalną (jako leczenie neoadiuwantowe),
w stadium zaawansowania T3 - T4 z objawami oraz w stadium
objawowym T1 - T2 u chorych niekwalifikujących się do leczenia
radykalnego [21]. Stosuje się dwie główne metody postępowania:
wytrzebienie chirurgiczne (orchidektomia obustronna) lub farmakologiczną - podawanie estrogenów, progestagenów, analogów hormonu
uwalniającego hormon luteinizujący (LH-RH, GnRH), antyandrogenów oraz substancji bezpośrednio hamujących syntezę androgenów
(ketokonazol, liarozol, aminoglutetimid).
Leczenie hormonalne niesie ze sobą wiele powikłań. Jednym z najistotniejszych
jest osteoporoza, obserwowana zarówno po kastracji chirurgicznej,
jak i po użyciu analogów LH-RH oraz antyandrogenów.
Mechanizm, który prowadzi do rozwoju zrzeszotnienia kości u mężczyzn z hipogonadyzmem, nie został poznany. Podejrzewa się współistnienie kilku procesów, które powodują utratę gęstości mineralnej
kości (BMD). Niektórzy autorzy sugerują, iż brak krążącego testosteronu
(T) powoduje osłabienie proliferacji osteoblastów. Inni postulują istnienie mechanizmu pośredniego, w którym niedobór T powoduje
niemożność obwodowej konwersji testosteronu do estrogenów,
które z kolei korzystnie wpływają na gęstość kości. Jeszcze inna teoria
zakłada zmniejszenie masy mięśniowej spowodowane niedoborem
T, co w następstwie zmniejszonego obciążenia fizycznego powoduje
obniżenie BMD [22]. Chociaż dyskusje co do mechanizmu nadal
trwają, to związek hipogonadyzmu męskiego w przebiegu terapii
antyandrogenowej z osteoporozą został udowodniony [23, 24].
Stwierdzono także związek osteoporozy u mężczyzn leczonych hormonalnie
z częstszym występowaniem złamań oraz skróceniem prze-
życia [3].
Jak można zapobiegać utracie masy kostnej u mężczyzn leczonych
antyandrogenowo z powodu PCa?
Rola i skuteczność bifosfonianów
Skuteczność bifosfonianów stosowanych doustnie w leczeniu pierwotnej
osteoporozy u mężczyzn jest dobrze potwierdzona. Orwoll i wsp.
wykazali, że skuteczność leczenia alendronianem (10 mg dziennie)
w połączeniu z wit. D i wapniem jest większa od skuteczności leczenia
tylko preparatami wit. D i wapnia. Stwierdzono istotny statystycznie
wzrost BMD, zarówno w obrębie kręgosłupa lędźwiowego, krętarza
większego oraz szyjki kości udowej, a także w innych kościch, co wiązało się z istotną statystycznie różnicą liczby złamań patologicznych [25].
Podobne wyniki leczenia alendronianem uzyskali także Gonnelli
i wsp. [26].
Rola bifosfonianów u mężczyzn z osteoporozą wtórną do ADT nie została jednoznacznie ustalona. Smith i wsp. opublikowali 2 badania,
w których udowadniają rolę pamidronianu [27] oraz zoledronianu [28]
podawanych dożylnie w prewencji utraty masy kostnej u mężczyzn
leczonych agonistą GnRH z powodu PCa zaawansowanego regionalnie
lub wznowy PCa bez przerzutów do kości. Pamidronian (60 mg
i.v. co 3 tygodnie) hamował rozwój osteoporozy, a zoledronian (4 mg
i.v. co 3 tygodnie) powodował nawet wzrost BMD u tych chorych. W pracach
tych nie badano jednak, czy istniała statystyczna różnica liczb
powikłań spowodowanych zmianami osteoporotycznymi pomiędzy
grupami otrzymującymi bifosfonian a grupami otrzymującymi placebo
i jak wpływało to na jakość życia, całkowite przeżycie oraz prze-
życie bez pojawienia się incydentu kostnego. Biorąc pod uwagę przeprowadzone
badania oraz udowodnioną rolę kwasu zoledronowego
w przerzutowym raku stercza, nie zaleca się rutynowego stosowania
bifosfonianów u chorych poddanych ADT z powodu PCa bez przerzutów
do kości [13]. Należy jednak u takich chorych kontrolować
gęstość kości, a leczenie zastosować w przypadku stwierdzenia progresji
osteopenii lub istnienia osteoporozy przed leczeniem, bądź
wystąpienia jej w czasie leczenia. W przypadku osteopenii zaleca się
doustnie alendronian 10 mg codziennie albo 70 mg raz w tygodniu
oraz alternatywnie rizedronian 5 mg dziennie lub 35 mg raz w tygodniu.
W przypadku progresji osteopenii lub stwierdzenia osteoporozy
zaleca się stosowanie dożylnie pamidronianu 60 mg co 3 miesiące
lub zoledronianu 4 mg co 3 miesiące [29]. W czasie stosowania bifosfonianów
niezbędne jest utrzymanie prawidłowego dowozu wapnia
oraz witaminy D lub jej aktywnych metabolitów [29, 30].
Witamina D i preparaty wapnia
Wprawdzie nie przeprowadzono badań dotyczących wpływu wit. D
oraz preparatów wapnia na gęstość kości u mężczyzn leczonych hormonalnie
z powodu PCa, jednak ich stosowanie wydaje się uzasadnione.
Dostępne są badania potwierdzające korzystny wpływ preparatów
wapnia do stosowania doustnego na gęstość kości w różnych grupach
ryzyka, między innymi u mężczyzn powyżej 65 roku życia [31]. Ponadto,
przyjmowanie doustnych preparatów wapnia zapobiega utracie
masy kostnej u chorych rozpoczynających glikokortykosteroidoterapię
[32]. Wydaje się, iż można spodziewać się podobnych efektów
u mężczyzn w czasie terapii antyandrogenowej. Suplementacja powinna
zapewnić całkowitą podaż dzienną wapnia w ilości 1000-1500 mg.
Preparaty należy podawać wieczorem, co zapobiega też zjawisku nocnej
resorpcji kości oraz nie utrudnia ewentualnego leczenia bifosfonianami,
które podaje się zazwyczaj rano. Lepszą wchłanialność wapnia z jelita
uzyskuje się podając je między posiłkami. Wielkość zalecanej dawki
wit. D nie została ustalona, jednak ze względu na powszechne jej niedobory
w Europie zaleca się stosowanie 400-800 j.m. na dobę u chorych
z osteoporozą oraz 700-800 mg na dobę u osób w wieku >60 lat [29].
Upośledzenie czynności nerek lub/i wątroby przyczynia się do spaczenia
metabolizmu wit. D, czyli do upośledzenia procesu enzymatycznego
przekształcenia endogennej (natywnej) wit. D3 w jej aktywne metabolity.
Witamina D3 (cholekacyferol, kalciol) powstaje w skórze z 7-dehydrocholesterolu
pod wpływem promieni pozafioletowych, w wątrobie
ulega hydroksylacji przy węglu 25, przechodząc w kalcydiol, który w nerkach
podlega kolejnej hydroksylacji przy węglu 1, przechodząc w kalcytriol,
najbardziej aktywną hormonalnie formę wit. D, która wywiera
wpływ na wchłanianie wapnia w jelicie oraz bierze udział w uwalnianiu
wapnia z kości, co prowadzi do zwiększenia stężenia Ca2+ we krwi.
Zatem u osób, u których czynność nerek lub wątroby jest upośledzona,
należy stosować aktywne formy wit. D3, czyli 1- lub 1,25-dwuhydroksycholekalcyferol.
Cechują się one krótszym okresem półtrwania
niż okres półtrwania form mniej aktywnych, co sprawia, że są bezpieczniejsze
i bardziej skuteczne. U chorych, u których BMD jest obniżona,
trzeba stosować rutynowo suplementację wapnia oraz wit. D3
lub jej aktywnych metabolitów [33].
Estrogeny
Leczenie preparatami estrogenów zostało zarzucone po opublikowaniu
badania przeprowadzonego przez Veterans Administration Cooperative
Urologic Research Group (VACURG). Wykazało ono wzrost
śmiertelności chorych aż o 36%, związany z powikłaniami terapii estrogenowej.
Ostatnio można jednak zaobserwować ponowny wzrost zainteresowania
leczeniem estrogenami chorych na PCa i powikłaniami
związanymi z tym leczeniem. Jedną z interesujących właściwości estrogenów
jest ich korzystny wpływ na utrzymanie masy kostnej. Sherr
i wsp. wykazali, iż jednoczesne podawanie dietylostilbestrolu (DES)
chorym poddanym wcześniej orchidektomii lub leczonych analogami
LH-RH z powodu PCa, zmniejsza istotnie zawartość metabolitów
kolagenu w moczu, co wskazuje na zmniejszenie obrotu kostnego [34].
Taxel i wsp. wykazali podobny wpływ mikronizowanego 17-β estradiolu
u chorych leczonych analogami LH-RH [35]. W obu wspomnianych
badaniach nie oceniano BMD. Ockrim i wsp., badając rolę estradiolu
podawanego przezskórnie w leczeniu zaawansowanego PCa,
stwierdzili przyrost BMD [36]. Nie zbadano jednak wpływu tego zjawiska
na częstość występowania powikłań szkieletowych. Wymienione
prace sugerują istnienie możliwości dołączania do terapii antyandrogenowej
niewielkich ilości estrogenów w celu ochrony kości. Takie postępowanie
wymaga jednak potwierdzenia w dalszych badaniach.
Selektywne modulatory receptora estrogenowego
Selektywne modulatory receptora estrogenowego (SERMs) są grupą
substancji, które mają powinowactwo do receptora estrogenowego,
przy czym charakter ich działania - estrogenowy lub antyestrogenowy
- zależy od tkanki, na którą oddziałują. Takie substancje jak raloxifen
czy tamoxifen mają działanie estrogenowe w tkance kostnej. Imitując
działanie estrogenów, powodują wzrost gęstości kostnej u kobiet z osteoporoz
ą. Wykazano także protekcyjne działanie tamoxifenu u kobiet
chorych na raka piersi. Smith i wsp. opublikowali w 2004 roku wyniki
badania, w którym wykazują ochronne działanie raloxifenu na układ
kostny chorych leczonych hormonalnie z powodu PCa [37]. Obecnie
prowadzone jest badanie nad skutecznością toremifenu. Jest jednak
jeszcze za wcześnie, by określić rolę SERMs w zapobieganiu osteoporozie
jatrogennej u chorych leczonych antyandrogenowo z powodu
PCa.
|
Algorytm postępowania
u pacjentów rozpoczynających terapię hormonalną |
 |
Fitoestrogeny
Fitśstrogeny są substancjami roślinnymi o słabym działaniu estrogenopodobnym.
Najczęściej występującą grupą są izoflawony, które
w największej ilości występują w soi, owocach i warzywach oraz dodawane
są do niektórych produktów mięsnych [38]. W badaniach
eksperymentalnych wykazano ich słabe hamujące działanie na osteoklasty
oraz działanie pobudzające osteoblasty. Atkinson i wsp. wykazali
korzystne działanie fitśstrogenów na szkielet u kobiet po menopauzie
[39]. Skuteczność tych substancji w leczeniu PCa nie jest jednak
jasna. Badania na modelach zwierzęcych wykazały, że działają one
proapoptotycznie na komórki nowotworowe [40, 41]. Wydaje się także,
iż mogą zmniejszać częstość występowania PCa u mężczyzn [42].
Dotychczas nie opublikowano badań nad wpływem fitśstrogenów
na gęstość kości mężczyzn leczonych antyandrogenowo z powodu PCa.
Styl życia
Modyfikacje stylu życia powinny uwzględniać regularne ćwiczenia fizyczne
- powodują one nie tylko wzrost gęstości kości, ale także przyrost
masy mięśniowej, poprawę wydolności fizycznej i ogólnego stanu
zdrowia. Regularne ćwiczenia fizyczne chorych na osteoporozę zmniejszają częstość złamań. Ćwiczyć należy 2-4 razy w tygodniu po 30 minut.
Modyfikacje żywieniowe powinny obejmować unikanie nadmiernej konsumpcji
alkoholu i kofeiny, zwiększenie spożycia świeżych warzyw
i owoców oraz nabiału. Chorych należy także zachęcać do zaprzestania
palenia tytoniu [29].
Podsumowanie
Powikłania kostne u chorych na PCa są częstymi i potencjalnie śmiertelnymi
następstwami naturalnego przebiegu tego nowotworu oraz
jego leczenia. W naszym kraju wzrasta częstość występowania PCa
oraz wydłuża się przeżycie chorych. Dlatego każdy lekarz, nie tylko
urolog, coraz częściej będzie spotykał się z mężczyznami leczonymi
z powodu PCa oraz z tymi, u których występują powikłania w czasie
leczenia. Zatem metody zapobiegania i leczenia uszkodzeń tkanki
kostnej u chorych na PCa powinny być znane ogółowi lekarzy. Dzięki
temu istnieje możliwość przedłużenia życia, zapewnienia komfortu
oraz szybkiej interwencji w razie wystąpienia powikłań.
Osoby odpowiedzialne za dystrybucję środków w systemie ochrony
zdrowia powinny zdać sobie sprawę, że zapobieganie i leczenie powik
łań kostnych w okresie długoterminowym daje finansowo znacznie
lepsze efekty niż następstwa braku odpowiedniego leczenia.
lek. med. Krzysztof Tupikowski, dr hab. n. med. Romuald Zdrojow,y prof. nadzw.
Katedra i Klinika Urologii i Onkologii Urologicznej AM, Wrocław
Pl. Jana Pawła II 8, 50-043 Wrocław
Piśmiennictwo:
- Wojciechowska U, Didkowska J, Tarkowski W, Zatoński W: Nowotwory złośliwe w Polsce w 2002 roku. Centrum Onkologii. Wyd. Instytut im. Marii Skłodowskiej-Curie, Warszawa 2004.
- Saad F, Clarke N, Colombel M: Natural history and treatment of bone complications in prostate cancer. Eur Urol 2006; 49: 429-40.
- Oefelein MG, Ricchiuti V, Conrad W, Resnick MI: Skeletal fractures negatively correlate with overall survival in men with prostate cancer. J Urol 2002; 168:1005-7.
- Zdrojowy R: Leczenie chorych na raka stercza z przerzutami do kości, w Wykłady z Urologii t.3, Polskie Towarzysto Urologiczne, Warszawa 2005.
- Bubendorf L, Schöpfer A, Wagner U, Sauter G, Moch H, Willi N, Gasser T, Mihatsch MJ: Metastatic patterns of prostate cancer: An autopsy study of 1589 patients. Hum Pathol 2000; 31: 578-83.
- Carlin BI, Andriole GL: The natural history, skeletal complications and management of bone metastases in patients with prostate cancer. Cancer 2000; 88 (suppl): 2989-94.
- Roelofs AJ, Thompson K, Gordon S, Rogers MJ: Molecular mechanisms of action of bisphosphonates: current status. Clin Cancer Res 2006; 12 (20 suppl): 6222-30.
- Saad F, Gleason DM, Murray R, Tchekmedyian S, Venner P, Lacombe L, Chin JL, Vinholes JJ, Goas JA, Zheng M: Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst 2004; 96: 879-82.
- Heidenreich A, Elert A, Hofmann R: Ibandronate in the treatment of prostate cancer associated painful osseous metastases. Prostate Cancer Prostatic Dis 2002; 5: 231-5.
- Ernst DS, Tannock IF, Winquist EW, Venner PM, Reyno M, Moore MJ, Chi K, Ding K, Elliot C, Parulekar W: Randomized, double-blind, controlled trial of mitoxantrone/prednisone and clodronate Versus mitoxantrone/prednisone and placebo in patients with hormone-refractory prostate cancer and pain. J Clin Oncol 2003; 21: 3335-42.
- Dearnaley DP, Sydes MR, Mason MD, Stott M, Powell CP, Robinson AC, Thompson PM, Moffat LE, Naylor SL, Parmar MK: A double-blind, placebo-controlled, randomized trial of oral sodium clodronate for metastatic prostate cancer (MRC PR05 Trial). J Natl Cancer Inst 2003; 95: 1300-11.
- Small EJ, Smith MR, Seaman JJ, Petrone S, Kowalski MO: Combined analysis of two multicenter, randomized, placebo-controlled studies of pamidronate disodium for the palliation of bone pain in men with metastatic prostate cancer. J Clin Oncol 2003; 21: 4277-84.
- Saad F, Guise T, Hussain A, Lance R, McKiernan J, Eastham J, Higano C: The role of intravenous bisphosphonates in the management of prostate cancer: treatment guidelines. Am J Urol Rev 2004; 2(2) suppl. 2: 9-15.
- Rosen LS, Gordon D, Kaminski M, Howell A, Belch A, Mackey J, Apffelstaedt J, Hussein MA, Coleman RE, Reitsma DJ, Chen BL, Seaman JJ: Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma: A randomized, double-blind, multicenter, comparative trial. Cancer 2003; 98:1735- 44.
- Rosen LS, Gordon D, Tchekmedyian S, Yanagihara R, Hirsh V, Krzakowski M, Pawlicki M, De Souza P, Zheng M, Urbanowitz G, Reitsma D, Seaman J :Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: A phase III, double-blind, randomized trial?The Zoledronic Acid Lung Cancer and Other Solid Tumors Study Group. J Clin Oncol 2003;21: 3150-7.
- Yeh HS, Berenson JR: Treatment for myeloma bone disease. Clin Cancer Res 2006;12(20 Suppl): 6279-84.
- Pawlicki M: Przerzuty nowotworowe do kości - nowe kierunki leczenia. ?-Medica Press, Bielsko Biała 2004.
- Brundage MD, Crook JM, Lukka H: Use of strontium-89 in endocrine-refractory prostate cancer metastatic to bone. Provincial Genitourinary Cancer Disease Site Group. Cancer Prev Controll 1998; 2: 79-87.
- Bauman G, Charette M, Reid R, Sathya J: Radiopharmaceuticals for the palliation of painful bone metastases?a systematic review. Radiother Oncol 2000; 75: 250-70.
- Smith-Jones PM: Radioimmunotherapy for prostate cancer. Q J Nucl Med Mol Imaging 2004; 48: 297-304.
- Demkow T: Leczenie hormonalne raka gruczołu krokowego w Wykłady z Urologii t.3. Polskie Towarzystwo Urologiczne, Warszawa 2005.
- McLeod N: Osteoporosis from androgen deprivation therapy in prostate cancer treatment. Aust Fam Physician 2006; 35: 243-5.
- Mittan D, Lee S, Miller E, Perez RC, Basler JW, Bruder JM: Bone loss following hypogonadism in men with prostate cancer treated with GnRH analogs. J Clin Endocrinol Metab 2002; 87: 3656-61.
- Maillefert JF, Sibilia J, Michel F, Saussine C, Javier RM, Tavernier C: Bone mineral density in men treated with synthetic gonadotropin-releasing hormone agonists for prostatic carcinoma. J Urol 1999; 161: 1219-22.
- Orwoll E, Ettinger M, Weiss S, Miller P, Kendler D,Graham J Adami S, Weber K, Lorenc R, Pietschmann P, Vandormael K, Lombardi A: Alendronate for the treatment of osteoporosis in men. N Engl J Med 2000; 343: 604-10.
- Gonnelli S, Cepollaro C, Montagnani A, Bruni D, Caffarelli C, Breschi M, Gennari L, Gennari C, Nuti R: Alendronate treatment in men with primary osteoporosis: a three-year longitudinal study. Calcif Tissue Int 2003; 73: 133-9.
- Smith MR, McGovern FJ, Zietman AL, Fallon MA, Hayden DL, Schoenfeld DA, Kantoff PW, Finkelstein JS: Pamidronate to prevent bone loss during androgen-deprivation therapy for prostate cancer. N Engl J Med 2001; 345: 948-55.
- Smith MR, Eastham J, Gleason DM, Shasha D, Tchekmedyian S, Zinner N: Randomized controlled trial of zoledronic acid to prevent bone loss in men receiving androgen deprivation therapy for nonmetastatic prostate cancer. J Urol 2003, 169: 2008-12.
- Bae DC, Stein BS: The diagnosis and treatment of osteoporosis in men on androgen deprivation therapy for advanced carcinoma of the prostate. J Urol 2004; 172: 2137-44.
- Eastham JA: Bone health in men receiving androgen deprivation therapy for prostate cancer. J Urol 2006; 177: 17-24.
- Dawson-Hughes B, Harris SS, Krall EA, Dallal GE: Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl J Med 1997; 337: 670-6
- Homik J, Suarez-Almazor ME, Shea B, Cranney A, Wells G, Tugwell P: Calcium and vitamin D for corticosteroid-induced osteoporosis. Cochrane Database Syst Rev 2000;(2):CD000952.
- Lorenc RS, Olszyński WP: Osteoporoza. Poradnik dla lekarzy. Biuro Gamma, Warszawa 2006, wyd. 2.
- Scherr D, Pitts WR Jr, Vaughan ED Jr: Diethylstilbestrol revisited: androgen deprivation, osteoporosis and prostate cancer. J Urol 2002; 167: 535-8.
- Taxel P, Fall PM, Albertsen PC, Dowsett RD, Trahiotis M, Zimmerman J, Ohannessian C, Raisz LG: The effect of micronized estradiol on bone turnover and calciotropic hormones in older men receiving hormonal suppression therapy for prostate cancer. J Clin Endocrinol Metab 2002; 87: 4907-13.
- Ockrim JL, Lalani EN, Banks LM, Svensson WE, Blomley MJ, Patel S, Laniado ME, Carter SS, Abel PD: Transdermal estradiol improves bone density when used as single agent therapy for prostate cancer. J Urol. 2004; 172: 2203-7.
- Smith MR, Fallon MA, Lee H, Finkelstein JS: Raloxifene to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate cancer: a randomized controlled trial. J Clin Endocrinol Metab. 2004; 89: 3841-6.
- Fitzpatrick LA: Phytoestrogens?mechanism of action and effect on bone markers and bone mineral density. Endocrinol Metab Clin North Am 2003; 32: 233-52.
- Atkinson C, Compston JE, Day NE, Dowsett M, Bingham SA: The effects of phytoestrogen isoflavones on bone density in women: a double-blind, randomized, placebocontrolled trial. Am J Clin Nutr 2004; 79: 326-33.
- Bylund A, Zhang JX, Bergh A, Damber JE, Widmark A, Johansson M, Adlercreutz H, Aman P, Shepherd MJ, Hallmans G. : Rye bran and soy protein delay growth and increase apoptosis of human LNCaP prostate adenocarcinoma in nude mice. Prostate 2000; 42: 304-14.
- Wikstrom P, Bylund A, Zhang JX, Hallmans G, Stattin P, Bergh A: Rye bran diet increases epithelial cell apoptosis and decreases epithelial cell volume in TRAMP (transgenic adenocarcinoma of the mouse prostate) tumors. Nutr Cancer. 2005; 53(1): 111-6.
- Pollard M, Wolter W: Prevention of spontaneous prostate related cancer in Lobund-Wistar rats by a soy protein isolate/isoflavone diet. Prostate 2000; 45: 101-5.
|
